题目内容
20.已知A和B生成C的反应方程式:2 A(g)+B(g)=x C(g).甲容器充入2mol A和1mol B,达平衡后,C在平衡混合气中的体积分数为φ、物质的量n1;乙容器中充入1.4mol A,0.7mol B和0.6mol C,达平衡后C在平衡混合气中的体积数为φ、物质的量为n2,下列说法正确的是( )| A. | 若甲乙两容器均为恒容容器,则x必等于2 | |
| B. | 若甲乙两容器均为恒压容器,则x必等于3 | |
| C. | 若甲为恒压容器,乙为恒容容器,且x不等于3,则n1必大于n2 | |
| D. | 若甲为恒容容器,乙为恒压容器,且x等于3,则n1必大于n2 |
分析 A.在恒温恒容下,开始甲容器充入2molA和1molB与开始乙容器中充入 1.4molA,0.7molB 和 0.6molC,达到平衡后,C的体积分数为φ,说明两个平衡为完全等效平衡,按化学计量数转化到左边,应该满足:n(A)=2mol、n(B)=1mol,另外,对于反应前后气体的计量数之和相等的反应,物质的投料呈相同比例时也是等效平衡;
B.若甲、乙两容器为恒压容器下,只要反应物成比例就等效,无论x取什么数,按化学计量数转化到左边,都满足n(A):n(B)=2:1,所以始终处于等效平衡;
C.若甲为恒压容器、乙为恒容容器,且 x≠3,则x=2时,开始甲容器充入2molA和1molB与开始乙容器中充入 1.4molA,0.7molB 和 0.6molC,达到平衡后,C的体积分数为φ,说明为完全等效平衡,所以n1=n2;
D.若甲为恒容容器、乙为恒压容器,且 x=3,则反应前后气体体积相等,气体的物质的量始终不变,所以n1=3mol,n2=于1.4mol+0.7mol+0.6molC=2.7mol.
解答 解:A.在恒温恒容下,开始甲容器充入2molA和1molB与开始乙容器中充入 1.4molA,0.7molB 和 0.6molC,达到平衡后,C的体积分数为φ,说明两个平衡为完全等效平衡,按化学计量数转化到左边,应该满足:n(A)=2mol、n(B)=1mol,则:1.4mol+$\frac{0.6}{x}$×2=2mol,解得:x=2,另外,对于反应前后气体的计量数之和相等的反应,物质的投料呈相同比例时也是等效平衡,所以x=3也是正确的,所以x可能为2或3,故A错误;
B.若甲、乙两容器为恒压容器下,只要反应物成比例就等效,开始甲容器充入2molA和1molB与开始乙容器中充入 1.4molA,0.7molB 和 0.6molC,无论x取什么数,按化学计量数转化到左边,都满足n(A):n(B)=2:1,所以始终处于等效平衡,故B错误;
C.若甲为恒压容器、乙为恒容容器,且 x≠3,则x=2时,开始甲容器充入2molA和1molB与开始乙容器中充入 1.4molA,0.7molB 和 0.6molC,达到平衡后,C的体积分数为φ,说明为完全等效平衡,所以n1=n2,故C错误;
D.若甲为恒容容器、乙为恒压容器,且 x=3,则反应前后气体体积相等,气体的物质的量始终不变,所以n1=3mol,n2=1.4mol+0.7mol+0.6molC=2.7mol,即n1必大于n2,故D正确,
故选:D.
点评 本题考查化学平衡计算,涉及等效平衡问题,关键是对等效平衡规律的理解掌握,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5s的平均速率v(A)=0.17mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(A)=0.41mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% | |
| D. | 相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆) |
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
| A. | 升高温度只能加快吸热反应速率 | |
| B. | 对于任何反应,增大压强都可加快反应速率 | |
| C. | 使用正催化剂只加快正反应速率 | |
| D. | 催化剂可以改变反应速率 |
| A. | 容器内压强不再随时间变化 | |
| B. | 混合气体的颜色不再改变 | |
| C. | I2与H2在混合气体中的体积分数相等 | |
| D. | H2、I2、HI的浓度相等 |
| A. | Cu(NO3)2 | B. | NO | C. | H2O | D. | H2 |
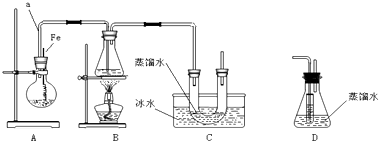
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$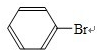 +HBr
+HBr