1.在一定体积的密闭容器中,发生如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
Ⅰ.该反应的平衡常数表达式为:K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
Ⅱ.该反应为吸热(填“吸热”或“放热”)反应.
Ⅲ.某温度下,反应体系中各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的反应温度为700℃.
Ⅳ.830℃时,向该容器中加入1molCO2与1molH2开始反应,达到平衡时,混合气体中CO2的体积分数是25%.
Ⅴ.保持温度不变,若往IV的平衡体系中再通入2molCO2与2molH2,则再达新平衡时,H2的转化率为50%.
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
Ⅱ.该反应为吸热(填“吸热”或“放热”)反应.
Ⅲ.某温度下,反应体系中各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的反应温度为700℃.
Ⅳ.830℃时,向该容器中加入1molCO2与1molH2开始反应,达到平衡时,混合气体中CO2的体积分数是25%.
Ⅴ.保持温度不变,若往IV的平衡体系中再通入2molCO2与2molH2,则再达新平衡时,H2的转化率为50%.
18.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
下列说法中不正确的是( )
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的 $\frac{1}{2}$,则c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% |
17.工业上消除氮氧化物的污染可用如下反应:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如表.下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
15.在2L密闭容器中,把4molA和2molB混合,在一定条件下发生反应:3A(g)+2B(g)?4C(g)+2D(g),该反应达到化学平衡状态时,生成1.6molC,则此条件下A的平衡转化率为( )
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
14.在一定的温度下,1L的密闭容器中通入H2和I2各0.016mol,发生如下反应:H2(g)+I2(g)?2HI(g).一段时间后达到平衡,测得数据如下:
请回答:
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
13. “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6 H2O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,得到如下数据:
(1)实验I中,前5min的反应速率υ(CO2)=0.1mol•L?1•min?1.
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是D.
A.容器内压强不再变化 B.$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=2
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验Ⅲ中:y=1.
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率a(H2O)随时间变化的示意图,如图所示,b点:υ正>υ逆(填“<”.“=”或“>”).
0 172473 172481 172487 172491 172497 172499 172503 172509 172511 172517 172523 172527 172529 172533 172539 172541 172547 172551 172553 172557 172559 172563 172565 172567 172568 172569 172571 172572 172573 172575 172577 172581 172583 172587 172589 172593 172599 172601 172607 172611 172613 172617 172623 172629 172631 172637 172641 172643 172649 172653 172659 172667 203614
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6 H2O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是D.
A.容器内压强不再变化 B.$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=2
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验Ⅲ中:y=1.
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率a(H2O)随时间变化的示意图,如图所示,b点:υ正>υ逆(填“<”.“=”或“>”).
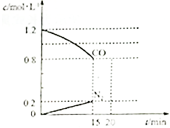 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程: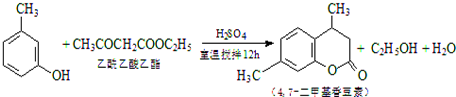
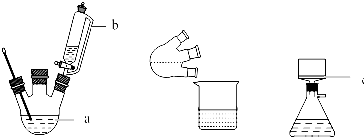
 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.