12.将9g铜和铁的混合物投入到100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是( )
| A. | 原混合物中铜和铁各0.075mol | |
| B. | 稀硝酸的物质的量浓度为2.0mol•L-1 | |
| C. | 第一次剩余4.8g金属为铜和铁 | |
| D. | 向反应后的溶液中再加入该稀硝酸100mL,又得到NO在标准状况下体积小于1.12L |
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A. | 三种气体密度最小的是X | |
| B. | 分子数目相等的三种气体,质量最大的是Y | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 20℃时,若2molY与1molZ体积相等,则Y、Z气体所承受的压强比为2:1 |
10.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法不正确的是( )
| A. | 原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的最高价氧化物对应水化物的酸性强 | |
| D. | Y的简单氢化物的热稳定性比W的强 |
9.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| D. | 0.1mol•L-1CH3COONa溶液:H+、Al3+、Cl-、NO3- |
8.下列关于离子的检验方法一定正确的是( )
| A. | 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ | |
| B. | 向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ | |
| C. | 向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- | |
| D. | 用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |
7.下列说法正确的是( )
| A. | 二氧化硫有漂白性,可用于加工食品使食品增白 | |
| B. | 从海水中提取碘常用过氧化氢做还原剂 | |
| C. | Na2SiO3是制备硅胶和木材防火剂的原料 | |
| D. | 铝热剂就是指铝和氧化铁的混合物 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,0.1molSO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| B. | 标准状况下,20gD2O分子中所含中子数为10NA | |
| C. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
5.向一定量的Cu、Fe2O3的混合物中加入100mL 2mol•L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
0 172449 172457 172463 172467 172473 172475 172479 172485 172487 172493 172499 172503 172505 172509 172515 172517 172523 172527 172529 172533 172535 172539 172541 172543 172544 172545 172547 172548 172549 172551 172553 172557 172559 172563 172565 172569 172575 172577 172583 172587 172589 172593 172599 172605 172607 172613 172617 172619 172625 172629 172635 172643 203614
| A. | 3.2g | B. | 2.4g | C. | 1.6g | D. | 0.8g |
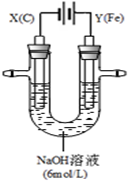 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.