题目内容
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )| A. | 三种气体密度最小的是X | |
| B. | 分子数目相等的三种气体,质量最大的是Y | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 20℃时,若2molY与1molZ体积相等,则Y、Z气体所承受的压强比为2:1 |
分析 根据题意三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),即Mr(X)<Mr(Y)<Mr(Z),
A、根据密度ρ=$\frac{M}{{V}_{m}}$来计算其相对大小;
B、根据m=nM=$\frac{N}{{N}_{A}}$来判断大小即可;
C、气体的物质的量n=$\frac{V}{{V}_{m}}$,Vm和气体的状态有关;
D、根据同温同体积的气体物质的量之比等于压强之比来计算.
解答 解:根据题意三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),即Mr(X)<Mr(Y)<Mr(Z),
A、根据密度ρ=$\frac{M}{{V}_{m}}$,气体处在相同的条件下,则密度和相对分子质量成正比,三种气体密度最小的是X,但是温度压强不定,所以Vm不一定,即密度无法判断,故A错误;
B、根据m=nM=$\frac{N}{{N}_{A}}$,分子数目相等的三种气体,质量最大的是相对分子质量最大的Z,故B错误;
C、气体的物质的量n=$\frac{V}{{V}_{m}}$,Vm和气体的状态有关,三种气体体积均为2.24 L,Vm不一定等于22.4L/mol,所以它们的物质的量不一定均为0.1mol,故C错误;
D、若2 molY与1mol,Z体积相等,则二者的物质的量之比是2:1,同温同体积的气体物质的量之比等于压强之比,Y、Z气体所承受的压强比为2:1,故D正确.
故选D.
点评 本题考查阿伏伽德罗定律及其推论,为高频考点,明确物质的量公式中各个物理量的关系是解本题关键,注意气体摩尔体积适用范围及适用条件,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
1.下列化学用语中,正确的是( )
| A. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl-+2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 氢氧燃料电池(KOH溶液为电解质溶液)的正极反应式:O2+2H2O+4e-═4OH- |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 48克O2和O3的混合物含有氧原子数3NA | |
| B. | 22.4L甲烷(CH4)所含的原子数为5NA | |
| C. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA | |
| D. | 在20℃,1.01×105Pa(即在标准状况)时,11.2L氧气所含的原子数为NA |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,0.1molSO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| B. | 标准状况下,20gD2O分子中所含中子数为10NA | |
| C. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
16.化学与环境密切相关,下列有关说法正确的是( )
| A. | CO2属于大气污染物 | |
| B. | 酸雨是pH小于7的雨水 | |
| C. | 大气中CO2含量的增加会导致温室效应加剧 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
3.下列离子反应方程式表示正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
20.下列各组表述中,两个微粒属于同种元素原子的是( )
| A. | M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2 的原子 | |
| B. | 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5 | |
| C. | 3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2 | |
| D. | 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p1的原子 |
1.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. | 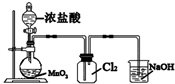 实验室制取Cl2 | D. | 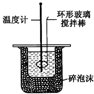 中和热的测定 |
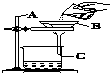 如图所示是某学生设计的过滤操作装置图.
如图所示是某学生设计的过滤操作装置图.