题目内容
13.三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:①写出该反应的化学方程式3NF3+5 H2O═9HF+2NO+HNO3,反应中生成0.2mol HNO3,转移的电子数目为0.4NA.
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是出现红棕色气体.
分析 由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,反应中只有N元素的化合价发生变化,NO易与空气中氧气反应生成红棕色的NO2气体,根据硝酸和转移电子之间的关系式计算;据此分析.
解答 解:①NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,
该反应中3NF3+5H2O=9HF+2NO+HNO3中,生成1molHNO3和转移电子2mol,所以若反应中生成0.2mol HNO3,转移的电子数目=0.2mol×2×NA/mol=0.4NA;
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
②反应中生成NO,NO易与空气中氧气反应生成红棕色的NO2气体;
故答案为:出现红棕色气体.
点评 本题考查含氮化合物的性质以及氧化还原反应,题目难度不大,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.实验室常用锌和稀硫酸反应制取氢气.在2mol/L的足量稀硫酸跟一定量的锌片反应制取氢气的实验中,为加快反应速率,又不影响生成氢气的总量,可以采用的方法是( )
| A. | 适当升高温度 | B. | 加入几滴硫酸铜溶液 | ||
| C. | 再加入少量浓硝酸 | D. | 加入适量的氯化钠溶液 |
4.下列电离方程式书写错误的是( )
| A. | NaHCO3═Na++HCO3- | B. | H2CO3═2H++CO32- | ||
| C. | NH3•H2O?NH4++OH- | D. | KAl(SO4)2═K++Al3++2SO42- |
1.$\stackrel{131}{53}$I是人工合成的,常用于医疗上放射性诊断,下列有关说法正确的是( )
| A. | $\stackrel{131}{53}$I核内的中子数比质子数多25个 | |
| B. | $\stackrel{131}{53}$I和$\stackrel{127}{53}$I都是自然界稳定存在的碘元素的同位素 | |
| C. | $\stackrel{131}{53}$I2和$\stackrel{127}{53}$I2互为同素异形体 | |
| D. | $\stackrel{131}{53}$I2可制成药物用于治疗甲状腺肿大 |
8.下列关于离子的检验方法一定正确的是( )
| A. | 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ | |
| B. | 向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ | |
| C. | 向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- | |
| D. | 用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |
18.下列晶胞中,属于面心立方最密堆积的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列除去杂质的操作中不正确的是( )
| A. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤 | |
| D. | 氯气中混有少量氯化氢气体:将混合气体分别通过盛饱和食盐水和浓H2SO4的洗气瓶 |
2.下列说法正确的是( )
| A. | 两种元素构成的共价化合物分子中的化学键一定都是极性键 | |
| B. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性分子中,一定含有非极性键 |
3.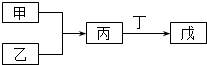 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )| A. | 若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物 | |
| B. | 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 | |
| C. | 若丙、丁混合产生大量白烟,则乙可能具有漂白性 | |
| D. | 若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |