4.下列有关化学用语表示正确的是( )
| A. | 二氧化硅的分子式:SiO2 | |
| B. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$K++HSO4- | |
| C. | 甲基的电子式: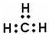 | |
| D. | HClO的结构式:H-Cl-O |
1.$\stackrel{131}{53}$I是人工合成的,常用于医疗上放射性诊断,下列有关说法正确的是( )
| A. | $\stackrel{131}{53}$I核内的中子数比质子数多25个 | |
| B. | $\stackrel{131}{53}$I和$\stackrel{127}{53}$I都是自然界稳定存在的碘元素的同位素 | |
| C. | $\stackrel{131}{53}$I2和$\stackrel{127}{53}$I2互为同素异形体 | |
| D. | $\stackrel{131}{53}$I2可制成药物用于治疗甲状腺肿大 |
20.某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组综合热测定的实验,实验试剂及其用量如表所示:
(1)实验①中碱液过量的目的是使盐酸充分反应,提高实验的准确度.
(2)甲同学预计△H1≠△H2,其依据是NH3•H2O是弱电解质,存在电离平衡,电离过程是吸热程.
(3)上表中终了温度为反应过程中混合溶液的最高温度(填“最高温度”或“平均温度”).
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热△H偏大(填“偏大”“偏小”或“不变”,下同).
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q偏小.
| 反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/kJ•mol-1 | |
| 硫酸 | 碱溶液 | |||
| ①0.5 mol•L-1 H2SO4溶液50 mL、1.0 mol•L-1 NaOH溶液50 mL | 25.1 | 25.1 | △H1 | |
| ②0.5 mol•L-1 H2SO4溶液50 mL、1.1mol•L-1 NH3•H2O溶液50 mL | 25.1 | 25.1 | △H2 | |
(2)甲同学预计△H1≠△H2,其依据是NH3•H2O是弱电解质,存在电离平衡,电离过程是吸热程.
(3)上表中终了温度为反应过程中混合溶液的最高温度(填“最高温度”或“平均温度”).
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热△H偏大(填“偏大”“偏小”或“不变”,下同).
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q偏小.
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 48克O2和O3的混合物含有氧原子数3NA | |
| B. | 22.4L甲烷(CH4)所含的原子数为5NA | |
| C. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA | |
| D. | 在20℃,1.01×105Pa(即在标准状况)时,11.2L氧气所含的原子数为NA |
18.下列叙述正确的是( )
| A. | 1molMg2+的质量为24g/mol | B. | 0.5molCH4中含有3.01×1023个电子 | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | CH4的摩尔质量为16g |
15.有关 分子结构的下列叙述中正确的是( )
分子结构的下列叙述中正确的是( )
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上.
0 172448 172456 172462 172466 172472 172474 172478 172484 172486 172492 172498 172502 172504 172508 172514 172516 172522 172526 172528 172532 172534 172538 172540 172542 172543 172544 172546 172547 172548 172550 172552 172556 172558 172562 172564 172568 172574 172576 172582 172586 172588 172592 172598 172604 172606 172612 172616 172618 172624 172628 172634 172642 203614
 分子结构的下列叙述中正确的是( )
分子结构的下列叙述中正确的是( )①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
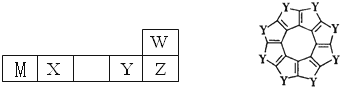 W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示,其中只有M为金属元素,请回答下列问题:
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示,其中只有M为金属元素,请回答下列问题: (1)为探究外界条件对化学平衡的影响某化学小组设计了如下实验:
(1)为探究外界条件对化学平衡的影响某化学小组设计了如下实验: