题目内容
16. (1)为探究外界条件对化学平衡的影响某化学小组设计了如下实验:
(1)为探究外界条件对化学平衡的影响某化学小组设计了如下实验:①已知:Cr2O${\;}_{7}^{2-}$+H2O?2CrO${\;}_{4}^{2-}$+2H++K2Cr2O7为橙色,K2CrO4为黄色.甲同学在5mL0.1mol/L K2Cr207的溶液中,加入几滴NaOH溶液后,观察到的现象为:溶液由橙色变为黄色;
②乙同学向盛有5mL0.005mol/L FeCl3溶液的试管中加入5mL0.0lmol/L KSCN,则发生反应的离子方程式为:Fe3++3SCN-?Fe(SCN)3,当往该混合溶液中加入几滴饱和FeCl3溶液后,溶液的颜色加深.
③由实验①和②可看出,两位同学探究的是浓度对化学平衡的影响的实验.
(2)已知KI溶液在酸性条件下易被氧化,I2遇淀粉变蓝色.现有①Imol/L KI溶液②0.1mol/L硫酸溶液③淀粉溶液,为探究溶液出现蓝色的时间与温度的关系.回答下列问题:
①该反应的离子方程式为4H++4I-+O2=2I2+2H2O;
②上述三种试剂加入的最佳顺序是 (填试剂序号)
③已知碘单质遇淀粉显蓝色是一放热过程,做该实验时选择的对比温度最好是A.
A.室温和0℃B.室温和40℃C.40℃和60℃
(3)某同学拟选用如图实验装置完成锌与稀硫酸反应速率的测定实验:
①你认为最简易的装置其连接顺序是:A接E接D接G(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻旋开分液漏斗活塞,稀硫酸顺利流入锥形瓶中,反应一会儿后,稀硫酸却不能再顺利滴人锥形瓶.请你帮助分析原因:锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,导致锥形瓶内压强增大.
③现取6.5g(足量)锌置于锥形瓶中,共加入1mol/L稀硫酸100mL充分反应后,5min末测得量筒中水的体积为672ml.(换算为标准状况),则该反应在5min内用H+浓度变化表示的平均反应速率为0.12mol/(L•min).(不考虑溶液体积变化和固体体积)
分析 (1)①根据氢氧根离子对该平衡的影响分析;
②铁离子与硫氰根离子发生反应生成硫氰化铁,该反应为可逆反应,据此写出反应的离子方程式;
③根据①②的操作方法及实验现象可知浓度影响化学平衡;
(2)①酸性条件下碘离子被空气中氧气氧化成碘单质,据此写出反应的离子方程式;
②应该先加入碘化钾溶液,然后滴加淀粉,溶液没有变蓝色,最后滴入稀硫酸,根据溶液颜色变化可判断温度对反应速率的影响;
③由于温度对反应速率较大,则反应温度不宜过高,否则难以探究出温度对反应速率的影响;
(3))①测量氢气的体积,最简易的装置其连接顺序EDG;
②锌与残余清液中硫酸铜反应生成铜,形成铜锌原池,大大加快了反应速率,反应生成大量气体且放热,导致锥形瓶内压强增大;
③量筒中水的体积等于氢气的体积,根据n=$\frac{V}{{V}_{m}}$计算出氢气的体积,然后根据氢元素守恒计算出氢离子的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算出该反应在5min内用H+浓度变化表示的平均反应速率.
解答 解:(1)①加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)向右移动,溶液由橙色变为黄色,
故答案为:溶液由橙色变为黄色;
②铁离子与硫氰根离子反应生成络合物硫氰化铁,反应的离子方程式为:Fe3++3SCN-?Fe(SCN)3,
故答案为:Fe3++3SCN-?Fe(SCN)3;
③根据①②可知,改变浓度,化学平衡会向着减弱这种改变的方向一定,所以探究的是浓度对化学平衡的影响,
故答案为:浓度对化学平衡的影响;
(2)①碘离子在酸性条件下易被氧气氧化成碘单质,反应的离子方程式为:4H++4I-+O2=2I2+2H2O,
故答案为:4H++4I-+O2=2I2+2H2O;
②淀粉遇碘变蓝色,实验中应先向一定体积的KI溶液中滴加淀粉溶液,然后再加入稀硫酸,在酸性条件下发生氧化还原反应生成碘,可根据颜色的变化判断反应速率,所以滴加顺序为:①③②,
故答案为:①③②;
③在较高温度下,反应速率都较大,则不易探究出温度对反应速率的影响,所以应该在降低温度下探究温度对反应速率的影响,故选A,
故答案为:A;
(3)①)①测量氢气的体积,最简易的装置其连接顺序EDG;
故答案为:E;D;G;
②由于锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,使锥形瓶内压强增大,导致稀硫酸却不能再顺利滴人锥形瓶,
故答案为:锌与残余清液中硫酸铜反应生成铜,铜锌形成原池,使锌与硫酸反应速率加快,反应生成大量气体且放热,导致锥形瓶内压强增大;
③5min末测得量筒中水的体积为672mL,则生成氢气的体积为672mL,氢气的物质的量为:0.672×22.4=0.03mol,H+的物质的量浓度为:0.03×2÷0.1=0.6mol/L,则反映速率为:0.06÷5=12mol/(L•min).
故答案为:0.12mol/(L•min).
点评 本题考查了性质实验方案的设计与评价,题目难度中等,设计性质实验方案的设计、化学平衡及其影响因素、化学反应速率的计算等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算、化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | 常温常压下,16gS03中含有的分子数为0.2NA | |
| B. | 常温下,30gSiO2晶体中含有Si--O键的数目为NA | |
| C. | 标准状况下,2.2 LCl2与足量水反应转移的电子数为0.1NA | |
| D. | 标准状况下,92.4 LNO与11.2LO2混合后所含分子数为NA |
| 元素 | 甲 | 乙 |
| 元素符号 | ①Na | ②Cl |
| 原子结构 示意图 |  | ③ 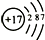 |
| 周期 | 三 | 三 |
| 族 | ④IA | VII A |
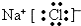 .
.(3)乙元素最高价氧化物对应水化物的化学式为HClO4.
(4)甲单质与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| A. | NaHCO3═Na++HCO3- | B. | H2CO3═2H++CO32- | ||
| C. | NH3•H2O?NH4++OH- | D. | KAl(SO4)2═K++Al3++2SO42- |
| A. | 乙烷中若混有乙烯,可通过酸性高锰酸钾溶液除去 | |
| B. | 乙醇中是否混有水,可用加入金属钠是否产生气体进行检验 | |
| C. | 蚕丝和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测 |
| A. | $\stackrel{131}{53}$I核内的中子数比质子数多25个 | |
| B. | $\stackrel{131}{53}$I和$\stackrel{127}{53}$I都是自然界稳定存在的碘元素的同位素 | |
| C. | $\stackrel{131}{53}$I2和$\stackrel{127}{53}$I2互为同素异形体 | |
| D. | $\stackrel{131}{53}$I2可制成药物用于治疗甲状腺肿大 |
| A. | 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ | |
| B. | 向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ | |
| C. | 向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- | |
| D. | 用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |
| A. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤 | |
| D. | 氯气中混有少量氯化氢气体:将混合气体分别通过盛饱和食盐水和浓H2SO4的洗气瓶 |
| A. | Al(OH)3与稀盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | AlCl3溶液中加入过量NH3•H2O:Al3++3OH-═Al(OH)3↓ | |
| C. | Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| D. | NaAlO2溶液中加入少量稀H2SO4溶液:AlO2-+4H+═Al3++4H2O |