题目内容
2.t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12.(1)该温度下,水的离子积常数Kw=10-12.
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=11,此时该溶液中由水电离的c(OH-)=10-11mol/L.
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是a+b=14.
分析 (1)水的离子积常数Kw=c(H+).c(OH-)=10-amol/L.10-bmol/L=10-12(mol/L)2;
(2)混合溶液中c(OH-)=$\frac{(0.4-0.1×2)×0.1}{0.1+0.1}$ mol/L=0.1mol/L,溶液中c(H+)=$\frac{1{0}^{-12}}{0.1}$mol/L=10-11mol/L;溶液呈碱性,碱抑制水电离,水电离出的氢氧根离子浓度等于溶液中氢离子浓度;
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中氢离子物质的量等于碱中氢氧根离子物质的量,据此计算.
解答 解:(1)水的离子积常数Kw=c(H+).c(OH-)=10-amol/L.10-bmol/L=10-12(mol/L)2,故答案为:10-12;
(2)混合溶液中c(OH-)=$\frac{(0.4-0.1×2)×0.1}{0.1+0.1}$ mol/L=0.1mol/L,溶液中c(H+)=$\frac{1{0}^{-12}}{0.1}$mol/L=10-11mol/L,则溶液的pH=11;溶液呈碱性,碱抑制水电离,水电离出的氢氧根离子浓度等于溶液中氢离子浓度,为10-11mol/L,故答案为:11;10-11mol/L;
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中氢离子物质的量等于碱中氢氧根离子物质的量,则溶液中100×10-a=1×10b-12,则a+b=14,
故答案为:a+b=14.
点评 本题以离子积常数为载体考查酸碱混合溶液定性判断,为高频考点,水的离子积常数与温度有关,注意酸或碱中水电离出的氢离子或氢氧根离子计算方法,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 0.4mol•L-1 | B. | 0.43mol•L-1 | C. | 0.8mol•L-1 | D. | 1.2mol•L-1 |
| A. | 金属氧化物、氧化铁、FeO | B. | 非金属氧化物、二氧化硫、SO2 | ||
| C. | 含氧酸、硫酸、H2SO3 | D. | 碱、纯碱、Na2CO3 |
 化学在生产生活中应用广泛,例如:(1)2013年春季,宁夏大部分地区进行了人工降雨;(2)为预防甲状腺肿大,在食用盐中加入碘酸钾(KIO3);(3)为了减少汽车尾气对空气的污染,用乙醇代替汽油作为汽车的燃料;(4)莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示.下列说法正确的是( )
化学在生产生活中应用广泛,例如:(1)2013年春季,宁夏大部分地区进行了人工降雨;(2)为预防甲状腺肿大,在食用盐中加入碘酸钾(KIO3);(3)为了减少汽车尾气对空气的污染,用乙醇代替汽油作为汽车的燃料;(4)莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示.下列说法正确的是( )| A. | AgI和干冰都可用于人工降雨 | |
| B. | 用米汤检验含碘食盐中是否含有碘元素 | |
| C. | 乙醇和汽油都是可再生能源 | |
| D. | 1mola能与4molNaOH完全反应 |
| A. | 二氧化硫有漂白性,可用于加工食品使食品增白 | |
| B. | 从海水中提取碘常用过氧化氢做还原剂 | |
| C. | Na2SiO3是制备硅胶和木材防火剂的原料 | |
| D. | 铝热剂就是指铝和氧化铁的混合物 |
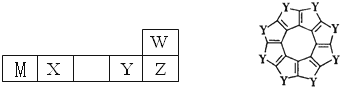 W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示,其中只有M为金属元素,请回答下列问题:
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示,其中只有M为金属元素,请回答下列问题: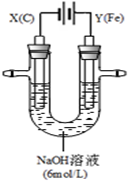 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.