5.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下.
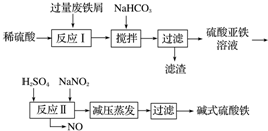
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
回答下列问题.
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
4.向硝酸钡溶液逐渐通入二氧化硫气体,可能发生的离子方程式如下,其中错误的是( )
| A. | 3SO2+2NO3-+2H2O═2NO↑+4H++3SO42- | |
| B. | 3SO2+Ba2++2NO3-+2H2O═BaSO4↓+2NO↑+4H++SO42- | |
| C. | 6SO2+Ba2++4NO3-+4H2O═BaSO4↓+4NO↑+8H++5SO42- | |
| D. | 3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+ |
3.常温下,水溶液中能大量共存的一组离子是( )
| A. | 与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3- | |
| B. | 在c(H+)=1.0×10-13,mol/L的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 澄清透明的溶液中:Fe3+、Mg2+、NO3-、S2- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
2. 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.
(1)实验室可由环己醇制备环己烯,反应的化学方程式是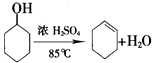 .
.
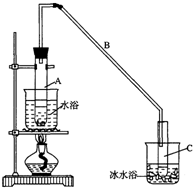
(2)实验装置如图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
环己醇和环己烯的部分物理性质如下:
①A中碎瓷片的作用是防止暴沸;导管B除了导气外还具有的作用是冷凝.
②试管A置于水浴中的目的是受热均匀,便于控温;试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料.(1)实验室可由环己醇制备环己烯,反应的化学方程式是
 .
.(2)实验装置如图所示,将10mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
环己醇和环己烯的部分物理性质如下:
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
②试管A置于水浴中的目的是受热均匀,便于控温;试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(3)环己烯粗品中含有少量环己醇和酸性杂质.精制环己烯的方法是:
①向环己烯粗品中加入C(填入编号),充分振荡后,分液(填操作名称).
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
②再对初步除杂后的环己烯进行蒸馏,得到环己烯精品.蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是除去产品中少量的水.
③实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是B.
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象.
1.某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4;b.澄清石灰水;c.灼热CuO;d.碱石灰;e.酸性品红溶液;f.定量酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是( )
| A. | G→a→c→f→b→d→c→b | B. | G→c→b→d→c→f→c→a | C. | G→a→e→f→b→d→c | D. | G→b→f→a→d→c→b |
20.能正确表示下列反应的离子方程式为( )
| A. | 向明矾(KAl(SO4)2•12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ |
19.有关电解质的说法正确的是( )
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO3水溶液的导电性很好,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
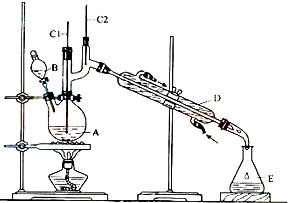
18.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(7)本实验中,正丁醛的产率为51.4%.
0 172408 172416 172422 172426 172432 172434 172438 172444 172446 172452 172458 172462 172464 172468 172474 172476 172482 172486 172488 172492 172494 172498 172500 172502 172503 172504 172506 172507 172508 172510 172512 172516 172518 172522 172524 172528 172534 172536 172542 172546 172548 172552 172558 172564 172566 172572 172576 172578 172584 172588 172594 172602 203614

CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(7)本实验中,正丁醛的产率为51.4%.