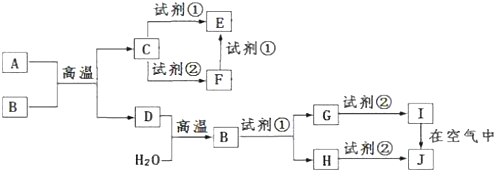
9.下列说法或表示法正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2 (g)+O2 (g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 | |
| D. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
8.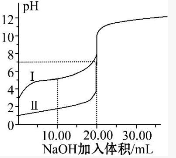 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00 mL时,QUOTE>1 | |
| C. | 当V(NaOH)=20.00 mL时,两种酸溶液的pH均等于7 | |
| D. | V(NaOH)=20.00 mL时,c(Cl-)<c(CH3COO-) |
7.下列有关电化学的图示完全正确的是( )
| A. | 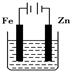 海水防止铁被腐蚀 | |
| B. | 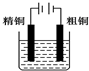 CuSO4精铜的精炼 | |
| C. |  ZnCl2溶液铁片镀锌 | |
| D. |  饱和食盐水验证NaCl溶液(含酚酞)电解产物 |
6. 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
5.某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、过氧化氢等物质作用,被还原为单质碘.
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取14.1g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3mol•L-1的Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32-=2I-+S4O62-)滴定至终点时消耗20.OOmL.
①实验前,首先要精确配制1.00×10-3mol•L-1Na2S2O3溶液250mL,配制时需要的仪器除电子天平、玻璃棒、烧杯、胶头滴管外,还需250mL容量瓶.
②滴定到终点时,溶液由蓝色为无色,且半分钟内未恢复.加碘食盐样品中的碘元素含量是30.0mg/kg(结果保留一位小数).
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
请推测实验③中产生蓝色现象的可能原因:加H2SO4后,溶液中O2氧化KI生成I2与淀粉作用显蓝色;根据学生乙的实验结果推测:学生甲的实验结果可能偏大(填“偏大”或“偏小”).
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全.仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸.
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取14.1g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3mol•L-1的Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32-=2I-+S4O62-)滴定至终点时消耗20.OOmL.
①实验前,首先要精确配制1.00×10-3mol•L-1Na2S2O3溶液250mL,配制时需要的仪器除电子天平、玻璃棒、烧杯、胶头滴管外,还需250mL容量瓶.
②滴定到终点时,溶液由蓝色为无色,且半分钟内未恢复.加碘食盐样品中的碘元素含量是30.0mg/kg(结果保留一位小数).
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴入淀粉KI溶液,振荡; | 溶液无变化 |
| ③ | 然后再滴加稀硫酸,振荡. | 溶液变蓝色 |
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全.仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸.
| 实验实验操作 | 实验实验现象及结论 |
4.氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗.纯化工业级氧化锌[含
有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO$→_{①}^{稀H_{2}SO_{4}}$ 浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$ $\stackrel{过滤}{→}$ 滤液$→_{③}^{Zn}$ $\stackrel{过滤}{→}$滤液 $→_{④}^{Na_{2}CO_{3}}$ 滤饼$→_{⑤}^{煅烧⑤}$ZnO
已知:a.在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2;
b.Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
回答下列问题:
(1)反应②中除掉的杂质离子是Fe2+、Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;在加高锰酸钾溶液之前,若pH较低,对除杂的影响是铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)反应③的反应类型为置换反应(填“化合反应”、“分解反应”、“置换反应”或“复分解反应”),过滤得到的滤渣中,除了过量的锌外还有镍;
(3)反应④形成的沉淀要用水洗,检验沉淀已洗涤干净的方法是取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2,取干燥后的滤饼22.4g,煅烧后可得到产品16.2g.则x等于1.
有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO$→_{①}^{稀H_{2}SO_{4}}$ 浸出液$→_{适量高锰酸钾溶液②}^{调pH约为5}$ $\stackrel{过滤}{→}$ 滤液$→_{③}^{Zn}$ $\stackrel{过滤}{→}$滤液 $→_{④}^{Na_{2}CO_{3}}$ 滤饼$→_{⑤}^{煅烧⑤}$ZnO
已知:a.在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2;
b.Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 |
(1)反应②中除掉的杂质离子是Fe2+、Mn2+,发生反应的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;在加高锰酸钾溶液之前,若pH较低,对除杂的影响是铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)反应③的反应类型为置换反应(填“化合反应”、“分解反应”、“置换反应”或“复分解反应”),过滤得到的滤渣中,除了过量的锌外还有镍;
(3)反应④形成的沉淀要用水洗,检验沉淀已洗涤干净的方法是取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净.
(4)反应④中产物的成分可能是ZnCO3•xZn(OH)2,取干燥后的滤饼22.4g,煅烧后可得到产品16.2g.则x等于1.
2.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加氯化钡溶液会产生白色沉淀 | 滴加氯化钡溶液产生白色沉淀的溶液中不一定含有Ag+离子 |
| B | 常温下铜与浓硝酸可以制取NO2 | 常温下铁与浓硝酸也可以制取NO2 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加氢碘酸生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
1. 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体;⑤生石灰.
0 172303 172311 172317 172321 172327 172329 172333 172339 172341 172347 172353 172357 172359 172363 172369 172371 172377 172381 172383 172387 172389 172393 172395 172397 172398 172399 172401 172402 172403 172405 172407 172411 172413 172417 172419 172423 172429 172431 172437 172441 172443 172447 172453 172459 172461 172467 172471 172473 172479 172483 172489 172497 203614
 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体;⑤生石灰.
| A. | ①②④⑤ | B. | ①②③ | C. | ②③⑤ | D. | ③④⑤ |