7. 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )| A. | 电解过程中OH-从a极区通过离子交换膜c进入b极区 | |
| B. | 随着电解进行,KOH溶液浓度会逐渐减小 | |
| C. | 当阳极有0.1mol I-放电时,阴极生成6.72LH2 | |
| D. | a电极反应式:I--6e-+6OH-═IO3-+3H2O,a极区的KI最终转变为KIO3 |
3.下列关于有机化合物的说法正确的是( )
| A. | 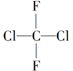 和 和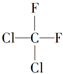 是两种不同的物质 是两种不同的物质 | |
| B. | 聚氯乙烯的单体为CH2═CHCl | |
| C. | 乙烷和乙烯均能使酸性KMnO4溶液褪色 | |
| D. | 1 mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
2.下列实验事实可以用同一反应原理解释的是( )
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
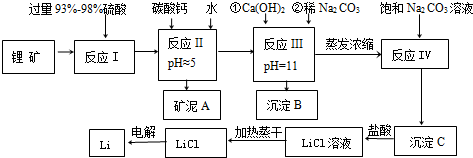
20.金属锂在通讯和航空航天领域中有重要的应用.以某锂矿为原料制取锂的工艺流程如下图,其主要成分为Li2O、Al2O3、SiO2,另含有FeO、MgO、CaO等杂质.
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如表:
请回答下列问题:
(1)锂矿中的FeO在反应 I中发生的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
(2)反应 II中pH的范围是4.7≤pH<9.6
(3)沉淀B中主要成分为CaCO3和Mg(OH)2(填化学式);沉淀C应使用热水 洗涤(选填“热水”或“冷水”)
(4)反应 IV发生的离子方程式为2Li++CO32-=Li2CO3
(5)电解熔融LiCl的阴极电极反应式为Li++e-=Li;阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)锂矿中的FeO在反应 I中发生的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
(2)反应 II中pH的范围是4.7≤pH<9.6
(3)沉淀B中主要成分为CaCO3和Mg(OH)2(填化学式);沉淀C应使用热水 洗涤(选填“热水”或“冷水”)
(4)反应 IV发生的离子方程式为2Li++CO32-=Li2CO3
(5)电解熔融LiCl的阴极电极反应式为Li++e-=Li;阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.
19. 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )| A. | 放电过程中,Li+向正极移动 | |
| B. | 常温下电解质是不导电的固体,电池不工作 | |
| C. | 每转移0.1 mol 电子,理论上生成20.7 g Pb | |
| D. | 该电池总反应为 PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb |
18.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
0 172264 172272 172278 172282 172288 172290 172294 172300 172302 172308 172314 172318 172320 172324 172330 172332 172338 172342 172344 172348 172350 172354 172356 172358 172359 172360 172362 172363 172364 172366 172368 172372 172374 172378 172380 172384 172390 172392 172398 172402 172404 172408 172414 172420 172422 172428 172432 172434 172440 172444 172450 172458 203614
| A. |  根据图可判断可逆反应 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  图表示压强对可逆反应2A (g)+2B (g)?2AB3 (g)的影响,乙的压强大 | |
| C. |  图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| D. |  图④是N2与H2合成氨的能量变化曲线,可确定该反应1 molN2和4mol H2充分反应时放热一定小于92kJ |

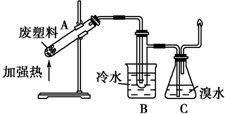 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
.