题目内容
7. 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )| A. | 电解过程中OH-从a极区通过离子交换膜c进入b极区 | |
| B. | 随着电解进行,KOH溶液浓度会逐渐减小 | |
| C. | 当阳极有0.1mol I-放电时,阴极生成6.72LH2 | |
| D. | a电极反应式:I--6e-+6OH-═IO3-+3H2O,a极区的KI最终转变为KIO3 |
分析 根据图知,a是阳极,b是阴极,电解时,阳极上碘离子失电子发生氧化反应,反应式为I--6e-+6OH-═IO3-+3H2O,阴极上得电子发生还原反应,反应式为6H2O+6e-═6OH-+3H2↑,据此分析解答.
解答 解:A、电解池中阴离子移向阳极,即OH-从b极区通过离子交换膜c进入a极区,故A错误;
B、电解时阴极上得电子发生还原反应,电极反应式为6H2O+6e-═6OH-+3H2↑,阳极上碘离子失电子发生氧化反应,电极反应式为I--6e-+6OH-═IO3-+3H2O,总反应为3H2O+I-═IO3-+3H2↑,所以KOH溶液浓度会逐渐增大,故B错误;
C、气体未指明标准状况,无法计算,故C错误;
D、在电解池的阳极a极,是碘离子发生失电子的氧化反应,最终生成碘酸根离子,反应式:I--6e-+6OH-═IO3-+3H2O,故D正确.
故选D.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,难点是电极反应式的书写,难度中等.

练习册系列答案
相关题目
15.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
实验步骤现象结论①分别取等体积的2mol/L的硫酸于试管中②反应速率:镁>铁,铜不反应金属的性质越活泼,反应速率越快
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.

实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.
2.下列实验事实可以用同一反应原理解释的是( )
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
12.有一真空密闭容器中,盛有amolPCl5,加热到200℃时,发生如下反应:PCl5(g)?PCl3(g)+Cl2(g),反应达平衡时,PCl5所占体积分数为M%,若在同一温度下,同一容器中,最初投入0.5amolPCl5反应达平衡时,PCl5所占体积分数为N%,则M与N的关系正确的是( )
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
19.下列说法中正确的是( )
| A. | 在标准状况下,1 mol水的体积约为22.4L | |
| B. | 只有在标准状况下,气体的摩尔体积才是22.4mol/L | |
| C. | 在标准状况下,1molH2和O2的混合气体体积约为22.4 L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L/mol |
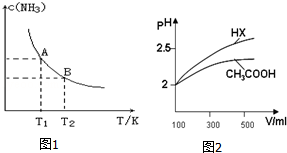 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应: