题目内容
5.在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质.请回答下列问题:
(1)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是SO2(填化学式),反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑
(2)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有BCD(填序号).
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(3)将(1)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色,说明这种气体具有漂白性;将(1)中产生的有刺激性气味的气体也可使溴水褪色,请写出该反应的化学方程式:SO2+Br2+2H2O=H2SO4+2HBr.
分析 (1)脱水过程中反应放热,所生产的碳和浓硫酸反应生成二氧化硫、二氧化碳和水;
(2)反应过程中表现了浓硫酸的脱水性生成碳,强氧化性和碳反应生成人欲横流和二氧化碳、水;
(3)产生的有刺激性气味的气体为二氧化硫,通入品红溶液中褪色,是二氧化硫的漂白性;产生的有刺激性气味的气体二氧化硫也可使溴水褪色.表现了二氧化硫的还原性,可以被溴单质氧化为硫酸.
解答 解:(1)黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是二氧化硫,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑,故答案为:SO2,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑;
(2)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质碳表现了浓硫酸的脱水性,黑色物质继续与浓硫酸作用会产生两种气体,体现了浓硫酸的强氧化性,过程中为表现酸性和脱水性,故答案为:BCD;
(3)有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫和溴水反应生成硫酸,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:褪色;漂白;SO2+Br2+2H2O=H2SO4+2HBr.
点评 本题考查了浓硫酸性质的分析判断,性质应用,蔗糖脱水过程中的反应 分析产物判断,实验验证,题目较简单.

练习册系列答案
相关题目
15.实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷,已知有关物质的性质如下:

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

(1)生成1-溴丁烷的化学方程式为CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(2)由于副反应的发生而可能产生的副产物有CH3CH2CH=CH2、CH3CH2CH2CH2OCH2CH2CH2CH3.(至少两种,有机物用结构简式表示)
(3)为了将反应混合物中1-溴丁烷及时分离出,应选用的装置是D(填序号),该操作应控制的温度t2范围是101.6℃≤t<117.25℃.
(4)在得到的1-溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”).
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1-溴丁烷的质量为22.2g,本实验的产率约是C(填正确答案标号).
A.40% B.50% C.60% D.70%
16.用50mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.该用品能否用铁质用品代替不能,原因是①铁的导热系数大,容易散热;②铁会与盐酸反应
(2)图示中用品填加后的装置叫量热器.
(3)烧杯间填满碎纸条的作用是保温,减少热量的散失.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”).
(5)如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,写出上述反应的热化学方程式NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值偏低(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.•℃),Q=C•m•△t则该反应的中和热为△H=-56.0kJ/mol.

(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.该用品能否用铁质用品代替不能,原因是①铁的导热系数大,容易散热;②铁会与盐酸反应
(2)图示中用品填加后的装置叫量热器.
(3)烧杯间填满碎纸条的作用是保温,减少热量的散失.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”).
(5)如果用60mL1.0mol/L盐酸与50mL1.1mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”).已知在稀溶液中强酸与强碱发生中和反应生成1mol水时放出57.3kJ的热量,写出上述反应的热化学方程式NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
(6)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(7)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值偏低(填偏高、偏低或不变);
(8)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
13.现有下列十种物质:①NH3 ②铁 ③Ba(OH)2 ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述十种物质中有两种物质之间可发生离子反应,H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O(写一个).
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为0.6mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+2OH-=CO32-+H2O.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为0.6mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+2OH-=CO32-+H2O.
20.金属锂在通讯和航空航天领域中有重要的应用.以某锂矿为原料制取锂的工艺流程如下图,其主要成分为Li2O、Al2O3、SiO2,另含有FeO、MgO、CaO等杂质.
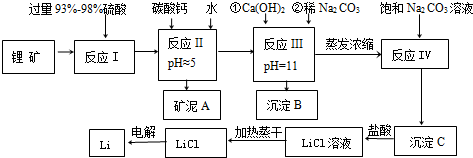
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如表:
请回答下列问题:
(1)锂矿中的FeO在反应 I中发生的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
(2)反应 II中pH的范围是4.7≤pH<9.6
(3)沉淀B中主要成分为CaCO3和Mg(OH)2(填化学式);沉淀C应使用热水 洗涤(选填“热水”或“冷水”)
(4)反应 IV发生的离子方程式为2Li++CO32-=Li2CO3
(5)电解熔融LiCl的阴极电极反应式为Li++e-=Li;阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)锂矿中的FeO在反应 I中发生的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
(2)反应 II中pH的范围是4.7≤pH<9.6
(3)沉淀B中主要成分为CaCO3和Mg(OH)2(填化学式);沉淀C应使用热水 洗涤(选填“热水”或“冷水”)
(4)反应 IV发生的离子方程式为2Li++CO32-=Li2CO3
(5)电解熔融LiCl的阴极电极反应式为Li++e-=Li;阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.
10.下列关于钠的叙述正确的是( )
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
17.已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D的质量为 32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为( )
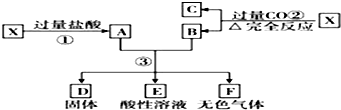

| A. | 4:1 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
15.下列离子方程式不正确的是( )
| A. | 碳酸钙与稀盐酸混合:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| D. | 把二氧化碳通入氯化钙溶液中:Ca2++H2O+CO2═CaCO3↓+2H+ |
 天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.