14.甲醇合成反应及其能量变化如图a所示:
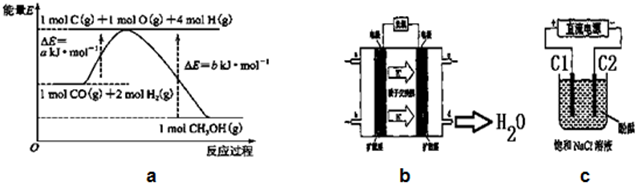
(1)写出合成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol.
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
在300℃反应开始10min内,H2的平均反应速率为v(H2)=0.08mol/(L•min).
(3)在500℃达到平衡时,平衡常数K=25.
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为80%.
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响,无影响.(填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式O2+4e-+4H+=2H2O.
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②电解开始后在电极C2的周围(填“C1”或“C2”)先出现红色.

(1)写出合成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol.
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500℃达到平衡时,平衡常数K=25.
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为80%.
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响,无影响.(填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式O2+4e-+4H+=2H2O.
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②电解开始后在电极C2的周围(填“C1”或“C2”)先出现红色.
13.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前 v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80% |
11.在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol/L,现有该温度下的四份溶液:①pH=2的CH3COOH、②0.01mol/L的HCl、③pH=11的氨水、④pH=11的NaOH溶液,下来说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |
9.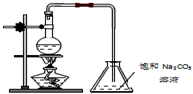 如图为制取乙酸乙酯的实验装置图,请回答下列问题:
如图为制取乙酸乙酯的实验装置图,请回答下列问题:
(1)实验室制取乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(3)若用图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:原料来不及反应就被蒸出,温度过高,发生了副反应,冷凝效果不好,部分产物挥发了等.
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因:
2CH3COOH+CO32-→2CH3COO-+CO2↑+H2O.
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题.现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
(说明:选择性100%表示反应生成的产物是乙酸乙酯和水)
根据表中数据,下列C(填编号),为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h.
 如图为制取乙酸乙酯的实验装置图,请回答下列问题:
如图为制取乙酸乙酯的实验装置图,请回答下列问题:(1)实验室制取乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(3)若用图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:原料来不及反应就被蒸出,温度过高,发生了副反应,冷凝效果不好,部分产物挥发了等.
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因:
2CH3COOH+CO32-→2CH3COO-+CO2↑+H2O.
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题.现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
根据表中数据,下列C(填编号),为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h.
8.化学在物质制备和环保领域有着重要的运用.
Ⅰ高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图1所示:
①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后溶液中c(Fe3+)=4×10-5mol•L-1,则Fe3+完全沉淀时的pH=3.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3﹕1.
(4)高铁电池是正在研制中的可充电干电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长、工作电压稳定.

0 172259 172267 172273 172277 172283 172285 172289 172295 172297 172303 172309 172313 172315 172319 172325 172327 172333 172337 172339 172343 172345 172349 172351 172353 172354 172355 172357 172358 172359 172361 172363 172367 172369 172373 172375 172379 172385 172387 172393 172397 172399 172403 172409 172415 172417 172423 172427 172429 172435 172439 172445 172453 203614
Ⅰ高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后溶液中c(Fe3+)=4×10-5mol•L-1,则Fe3+完全沉淀时的pH=3.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3﹕1.
(4)高铁电池是正在研制中的可充电干电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长、工作电压稳定.

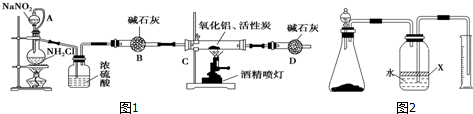

 .
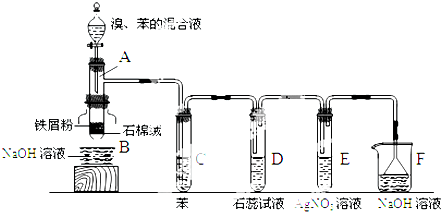
.
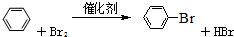 .
. 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题: 阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下:
阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下: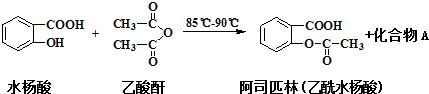

 ;
;