��Ŀ����
12�� ����[H2NCONH2]����һ�ַdz���Ҫ�ĸߵ����ʣ����Ƕ����л�������Ʒ������ԭ�ϣ���ҵ���Ժϳɰ�����NH3��CO2Ϊԭ���������أ���ش��������⣺
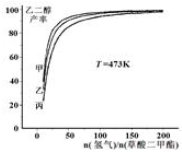
����[H2NCONH2]����һ�ַdz���Ҫ�ĸߵ����ʣ����Ƕ����л�������Ʒ������ԭ�ϣ���ҵ���Ժϳɰ�����NH3��CO2Ϊԭ���������أ���ش��������⣺��1��ijʵ����ģ�ҵ�ϳɰ���������ͬ�����µ��ܱ������зֱ����N2��H2��Ũ�Ⱦ�Ϊc��N2��=0.100mol/L��c��H2��=0.300mol/L�����з�Ӧʱ��N2��Ũ����ʱ��ı仯�ֱ���ͼ���ߢ���ʾ��
��0��20minʱ��ʵ�����v��N2��=0.002mol/��L•min��
��ʵ�����H2��ƽ��ת����Ϊ40%
����ʵ�����ȣ�ʵ���ֱ���ı�һ����Ӧ������д�����ı���������жϵ����ɣ���������������ƽ��ʱ�����̣�ƽ��ʱ����Ũ��δ�䣻
�������¶ȣ�����ӦΪ���ȷ�Ӧ��ƽ�������ƶ������̵���ƽ��ʱ�䣬ƽ��ʱ������Ũ������
��2���ϳ����صķ�ӦΪ2NH3��l��+CO2��g��?H2O��l��+H2NCONH2��l����H=-101.99kJ/mol���÷�Ӧ�ڽ���ʱ��Ϊ����������
��һ����2NH3��l��+CO2��g��?H2NCOONH4��l����H1
�ڶ�����H2NCOONH4��l��?H2O��l��+H2NCONH2��l����H2=+15.05kJ/mol
�����ܷ�Ӧ�Ŀ����ɵڶ�����Ӧ��������ڶ�����Ӧ�ķ�Ӧ���ʣ������������������=������һ����Ӧ�ķ�Ӧ���ʣ�
�ڡ�H1=-117.04kJ/mol��
��3������ʩ����������Ҫ����������������ˮ��Ϊ̼��炙�̼����泥����ܱ�ũ�����ϵ���գ�д������ˮ��Ϊ̼��淋Ļ�ѧ����ʽH2NCONH2+2H2O=��NH4��2CO3��
��4������ʪ���������������类��ѧ�����Ͽ������÷�����������Ϊ����Һ�ѳ������е�NOx��ȡ���˽Ϻõ�Ч����������NO��NO2�����ʵ���֮��1��1��������Һ���������������壮��1mol����������������������������ֻ����NO��NO2���������Ϊ1��1��������Ϊ76g��
���� ��1������ͼ��֪��20minʱ����ƽ�⣬������Ũ�ȱ仯��Ϊ��1-0.06��mol/L=0.04mol/L���ٸ���v=$\frac{��c}{��t}$����v��N2����
��ʵ�����ƽ��ʱ������Ũ�ȱ仯��Ϊ��1-0.06��mol/L=0.04mol/L���ɷ���ʽ��֪������Ũ�ȱ仯��Ϊ0.04mol/L��3=0.12mol/L������ת����=$\frac{����Ũ�ȱ仯��}{������ʼŨ��}$��100%��
����ʵ�����ȣ�ʵ���Ӧ���ʼӿ죬ƽ���Ũ�Ȳ��䣬����������ѹǿ�������¶ȣ������Ǽ����������ʵ���Ӧ���ʼ�����ƽ��ʱ������Ũ����������ӦΪ�����С�ķ��ȷ�Ӧ�������Ǽ�Сѹǿ�������ǽ��������¶ȣ�
��2��������Ӧ�����������̵ķ�Ӧ���ʣ�
�ڸ��ݸ�˹���ɣ���֪��H1=��H-��H2��
��3����������ˮ��Ϊ̼�����д��ѧ����ʽ��
��4��������NO��NO2�����ʵ���֮��1��1��������Һ���������������壬Ӧ���ɵ�����������̼����Ӧ����ʽΪ��NO+NO2+H2NCONH2=2N2+CO2+2H2O����Ϸ���ʽ���㣮
��� �⣺��1������ͼ��֪��20minʱ����ƽ�⣬������Ũ�ȱ仯��Ϊ��1-0.06��mol/L=0.04mol/L����v��N2��=$\frac{0.04mol/L}{20min}$=0.002mol/��L•min�����ʴ�Ϊ��0.002mol/��L•min����
��ʵ�����ƽ��ʱ������Ũ�ȱ仯��Ϊ��1-0.06��mol/L=0.04mol/L���ɷ���ʽ��֪������Ũ�ȱ仯��Ϊ0.04mol/L��3=0.12mol/L������ת����=$\frac{0.12mol/L}{0.3mol/L}$��100%=40%���ʴ�Ϊ��40%��
����ʵ�����ȣ�ʵ���Ӧ���ʼӿ죬ƽ���Ũ�Ȳ��䣬����������ѹǿ�������¶ȣ������Ǽ����������ʵ���Ӧ���ʼ�����ƽ��ʱ������Ũ����������ӦΪ�����С�ķ��ȷ�Ӧ�������Ǽ�Сѹǿ�������¶ȷ�Ӧ���ʼӿ죬ƽ�������ƶ��������������¶ȣ�
�ʴ�Ϊ���������������ƽ��ʱ�����̣�ƽ��ʱ����Ũ��δ�䣻�����¶ȣ�����ӦΪ���ȷ�Ӧ��ƽ�������ƶ������̵���ƽ��ʱ�䣬ƽ��ʱ������Ũ������
��2��������Ӧ�����������̵ķ�Ӧ���ʣ����ܷ�Ӧ�Ŀ����ɵڶ�����Ӧ��������ڶ�����Ӧ�ķ�Ӧ���ʣ���һ����Ӧ�ķ�Ӧ���ʣ��ʴ�Ϊ������
�ڸ��ݸ�˹���ɣ���֪��H1=��H-��H2=-101.99kJ/mol-15.05kJ/mol=-117.04kJ/mol���ʴ�Ϊ��-117.04kJ/mol��
��3������ˮ��Ϊ̼��泥���ѧ����ʽΪ��H2NCONH2+2H2O=��NH4��2CO3���ʴ�Ϊ��H2NCONH2+2H2O=��NH4��2CO3��
��4��������NO��NO2�����ʵ���֮��1��1��������Һ���������������壬Ӧ���ɵ�����������̼����Ӧ����ʽΪ��NO+NO2+H2NCONH2=2N2+CO2+2H2O���ɷ���ʽ��֪1mol����������1molNO��1molNO2����������������������Ϊ1mol����30g/mol+46g/mol��=76g��
�ʴ�Ϊ��76��
���� ���⿼�黯ѧ��Ӧ���ʼ��㡢��ѧƽ����㼰Ӱ�����ء���Ӧ����ʽ����ȣ����ض�ѧ�����������Ŀ��飬��4���еĹؼ�����д����ʽ���Ѷ��еȣ�

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
a��0��t1ʱ��v����v����t2ʱ��v����v��
b�����������ܶȲ��ٸı�ʱ���������̴ﵽƽ��
c��t2ʱ�̸ı���������������ܱ������м�C
d���������̴ﵽƽ��ʱ��ƽ�ⳣ����
��2����ҵ�ϳ���CO2��NH3ͨ�����·�Ӧ�ϳ�����[CO��NH2��2]��
CO2��g��+2NH3��g��$\stackrel{һ������}{?}$CO��NH2��2��1��+H2O��g����H��0
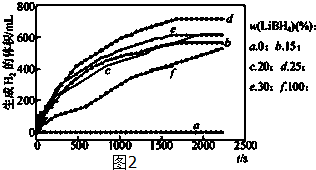
t��ʱ�����ݻ��㶨Ϊ2L���ܱ������м���0.10molCO2��0.40molNH3��70min��ʼ�ﵽƽ�⣮��Ӧ��CO2�� g�������ʵ�����ʱ��仯�����ʾ��
| ʱ��/min | ��0 | 20 | 70 | 80 | 100 |
| n��CO2��/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
����100minʱ�����������������䣬���������г���0.050mo1CO2��0.20molNH3�����½���ƽ���CO2��ת������ԭƽ����Ƚ���������������䡱��С������
���������淴Ӧ��ƽ�ⳣ��Ϊ277.8������һλС������
��ͼ2��ʾװ�ã�����������Ϊ���Ե缫�������ڵ�����ء�CO��NH2��2���ļ�����Һ��ȡ��������װ���������ĵ缫��ӦʽΪCO��NH2��2+8OH--6e-=CO32-+N2��+6H2O��
��3��CH4ȼ�ϵ�أ�װ��ʾ����ͼ3��A��BΪ�����̼����������ͨ����飬�ڱ�״���£����ļ������VL���� V=44.8Lʱ������ܷ�Ӧ����ʽΪCH4+2O2+KOH=KHCO3+2H2O��
 +2KMnO4$\stackrel{��}{��}$
+2KMnO4$\stackrel{��}{��}$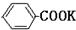 +KOH+2MnO2��+H2O
+KOH+2MnO2��+H2O +HCl��
+HCl��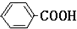 +KCl
+KClʵ�鷽����һ�����ļױ���KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ�����������̷����������ͻ���δ��Ӧ�ļױ���

��֪���������������122���۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g�����������л���һ�㶼�й̶��۵㣮
��1��������Ϊ��Һ��������Ϊ����
��2����ɫҺ��A�Ǽױ������Լ���A���Լ�������KMnO4��Һ����������Һ��ɫ��
��3���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ���ͬѧ�Ʋ��ɫ����B�DZ�������KCl�Ļ�����������·��������ᴿ�ͼ��飬ʵ���������Ʋ���ȷ�����ڴ������ɱ������ݣ�
| ��� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ɫ����B����ˮ�У��ܽ� ��ȴ�����ˣ� | �õ���ɫ�������ɫ��Һ | -- |
| �� | ȡ������Һ���Թ��У�����2-3��AgNO3��Һ | ���ɰ�ɫ���� | ��Һ����Cl- |
| �� | �����ɫ���壬����ʹ���ڻ��������۵� | �۵�Ϊ122.4�� | ��ɫ�����DZ����� |
| A�� | �����������뵼����� | |
| B�� | RbOH�ļ���ǿ��Ca��OH��2 | |
| C�� | SrCO3�ǰ�ɫ������ˮ����������Ļ����� | |
| D�� | ��������AgAt���ǰ�ɫ������ϡ����Ļ����� |
| A�� | ����Ԫ����ɵķ�����������ѧ��һ�����Ǽ��Լ� | |
| B�� | ����������۵�һ���ȷ��Ӿ���ĸ� | |
| C�� | ij�����к��������ӣ���һ��Ҳ���������� | |
| D�� | ���������ӵĻ�����һ������������ |

 ��
��