8. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
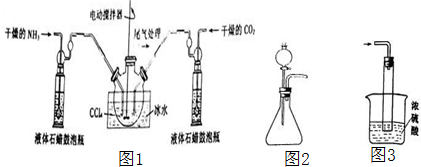
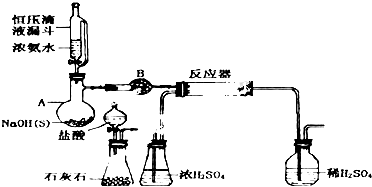
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图:有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
写出吸收酸性气体的化学反应方程式CO2+2NaOH=Na2CO3+H2O;SO2+2NaOH=Na2SO3+H2O.
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
写出吸收酸性气体的化学反应方程式CO2+2NaOH=Na2CO3+H2O;SO2+2NaOH=Na2SO3+H2O.
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
6.Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%.质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
(2)写出实验室制备A的化学方程式CH3COOH+HOCH2CH3$\stackrel{浓硫酸}{?}$CH3COOCH2CH3+H2O.
Ⅱ.苯甲酸甲酯 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(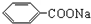 )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为64.7℃,操作③为分液,操作④为蒸馏.
(2)第②步加热的目的是蒸出过量的甲醇.
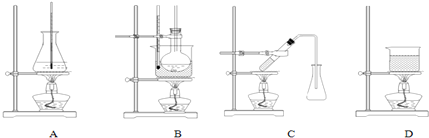
(3)选择合适的制备苯甲酸甲酯的装置:B.
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式 .
.
①为芳香化合物 ②含有醛基 ③能与金属Na反应.
 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.(2)写出实验室制备A的化学方程式CH3COOH+HOCH2CH3$\stackrel{浓硫酸}{?}$CH3COOCH2CH3+H2O.
Ⅱ.苯甲酸甲酯
 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:| 熔点℃ | 沸点℃ | 水溶性 | |
| 甲醇 | -97.8 | 64.7 | 易溶 |
| 苯甲酸 (一元弱酸) | 122.4 | 249.3 | 常温:0.17g 100℃:6.8g |
| 苯甲酸甲酯 | -12.3 | 198 | 难溶 |

请回答下列问题:
(1)温度①约为64.7℃,操作③为分液,操作④为蒸馏.
(2)第②步加热的目的是蒸出过量的甲醇.
(3)选择合适的制备苯甲酸甲酯的装置:B.

(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式
 .
.①为芳香化合物 ②含有醛基 ③能与金属Na反应.
4.氯化铜用途广泛,常用于生产颜料、木材防腐剂等.
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备氯化铜固体.
①仪器z的名称是分液漏斗.
②检验装置A气密性的操作为:关闭活塞,向分液漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气.
③实验过程中按照气流方向仪器接口连接顺序a→hidebc(cb)f,实验中D装置的作用是防止空气中水蒸气进入B,同时吸收多余的Cl2,防止空气污染.
(2)某研究小组模拟工业用粗铜(含杂质Fe)按下述流程制备无水CuCl2.
已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
①溶液A中加入氧化剂X的目的是把Fe2+氧化为Fe3+.
②加试剂Y用于调节pH以除去杂质,则应调节pH范围是3.7≤pH<4.4,试剂Y可选用下列中的cd(填序号).
a.NaOH b.盐酸 c.CuO d.Cu2(OH)2CO3
③由溶液B制备无水CuCl2过程中的操作有:a.冷却结晶;b.过滤洗涤;c.蒸发浓缩;d.在干燥HCl气流中加热.则其操作顺序为cabd(填写序号).
0 172101 172109 172115 172119 172125 172127 172131 172137 172139 172145 172151 172155 172157 172161 172167 172169 172175 172179 172181 172185 172187 172191 172193 172195 172196 172197 172199 172200 172201 172203 172205 172209 172211 172215 172217 172221 172227 172229 172235 172239 172241 172245 172251 172257 172259 172265 172269 172271 172277 172281 172287 172295 203614
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备氯化铜固体.

①仪器z的名称是分液漏斗.
②检验装置A气密性的操作为:关闭活塞,向分液漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气.
③实验过程中按照气流方向仪器接口连接顺序a→hidebc(cb)f,实验中D装置的作用是防止空气中水蒸气进入B,同时吸收多余的Cl2,防止空气污染.
(2)某研究小组模拟工业用粗铜(含杂质Fe)按下述流程制备无水CuCl2.

已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
②加试剂Y用于调节pH以除去杂质,则应调节pH范围是3.7≤pH<4.4,试剂Y可选用下列中的cd(填序号).
a.NaOH b.盐酸 c.CuO d.Cu2(OH)2CO3
③由溶液B制备无水CuCl2过程中的操作有:a.冷却结晶;b.过滤洗涤;c.蒸发浓缩;d.在干燥HCl气流中加热.则其操作顺序为cabd(填写序号).
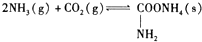



 .
.