题目内容
9.氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:①常温下,在干燥的空气中稳定,遇水或潮湿空气则生成碳酸铵或碳酸氢铵;
②熔点58℃,59℃则可分解成NH3和CO2气体;
③在密封管内加热至120℃~140℃时失水生成尿素[CO(NH2)2];
④酸性溶液中迅速分解;
⑤合成氨基甲酸铵原理为:
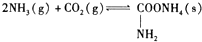
(1)写出氨基甲酸铵在密封管内加热至120℃~140℃生成尿素的反应方程式:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O.
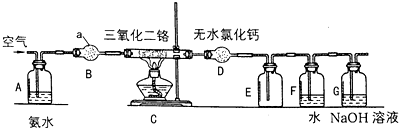
(2)仪器B名称干燥管;盛放药品是:碱石灰;
(3)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热△H<0(填“>”“=”或
“<”).
(4)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:(回答二点)
①无需干燥,装置简单;②低温环境提高产率.
(5)该实验装置中有明显导致实验失败的隐患有:(指出主要二处)
①反应器连接导管过细易造成堵塞;②稀H2SO4水蒸气可进入反应器使产品不纯等.
分析 (1)对比氨基甲酸铵的结构简式与尿素的结构简式可写出反应方程式;
(2)依据图形和作用分析仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰;
(3)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0;
(4)使用干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成;不用对干冰进行干燥处理;
(5)导管过细有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等.
解答 解:(1)对比氨基甲酸铵的结构简式与尿素的结构简式,依据原子守恒得到氨基甲酸铵在密封管内加热至120℃-140℃生成尿素的反应方程式为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O,
故答案为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O;
(2)仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰,用来干燥氨气,
故答案为:干燥管;碱石灰;
(3)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0,△H<0,
故答案为:<;
(4)干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作,无需干燥,装置简单;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成,不用对干冰进行干燥处理,低温环境提高产率,
故答案为:无需干燥,装置简单;低温环境提高产率;
(5)从实验装置可以看出导管过细,有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等,
故答案为:①反应器连接导管过细易造成堵塞;
②稀H2SO4水蒸气可进入反应器使产品不纯;
③CO2发生器中挥发的HCl未经处理进入反应器,会导致实验失败.
点评 本题考查了实验过程分析和评价,实验设计方法的理解应用,掌握实验基本操作和基础是关键,题目难度中等.

| A. | 某地燃烧化石燃料排放的废气中含CO2、SO2,使雨水pH=6形成酸雨 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 | |
| D. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
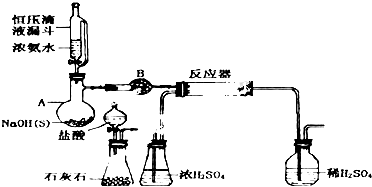
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备氯化铜固体.

①仪器z的名称是分液漏斗.
②检验装置A气密性的操作为:关闭活塞,向分液漏斗中加水至其液面高于试管中的液面,(停止加水)一段时间后液面高度差没变化,说明装置不漏气.
③实验过程中按照气流方向仪器接口连接顺序a→hidebc(cb)f,实验中D装置的作用是防止空气中水蒸气进入B,同时吸收多余的Cl2,防止空气污染.
(2)某研究小组模拟工业用粗铜(含杂质Fe)按下述流程制备无水CuCl2.

已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
②加试剂Y用于调节pH以除去杂质,则应调节pH范围是3.7≤pH<4.4,试剂Y可选用下列中的cd(填序号).
a.NaOH b.盐酸 c.CuO d.Cu2(OH)2CO3
③由溶液B制备无水CuCl2过程中的操作有:a.冷却结晶;b.过滤洗涤;c.蒸发浓缩;d.在干燥HCl气流中加热.则其操作顺序为cabd(填写序号).
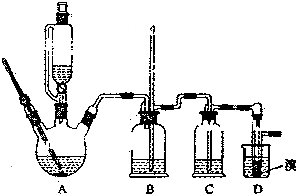 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}So_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BRCH2B
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下;
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/°C | 78.5 | 132 | 34.6 |
| 熔点/°C | -130 | 9 | -116 |
(1)A装置上方使用滴液漏斗的优点是:便于漏斗内液体顺利流下;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)B装置的作用是平衡压强,检查装置是否发生堵塞.
(3)在装置C中应加入C(填正确选项前的字母),其目的是吸收反应产物的SO2和CO2酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(5)D装置具支试管内若用嗅水代替液溴(假定产物相同),分析其优点生成的1,2-二溴乙烷和水分层,水在上层起液封作用,防止产品挥发.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 若不改变其它条件而换用一种更高效的催化剂,则反应达限度的时间会增长 | |
| B. | 达平衡后向容器中只充入O2不能提高反应速率 | |
| C. | 达到平衡时,SO2的转化率是80% | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为114.90g |
| A. | 都是2mol/L | B. | 都是3mol/L | ||
| C. | 1.5mol/L和3mol/L | D. | 分别是1mol/L和4mol/L |