12.下列说法正确的是( )
| A. | 向Na2SO4溶液中加入过量BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42- | |
| B. | Ksp小的物质的溶解能力一定比Ksp大的物质的小 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 洗涤沉淀时,洗涤次数越多越好 |
10.下列现象或事实可用同一原理解释的是( )
| A. | 铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 | |
| B. | 氢氟酸和氢氧化钠溶液都能溶解二氧化硅 | |
| C. | 次氯酸和二氧化硫都具有漂白作用,能使品红溶液褪色 | |
| D. | H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
7.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2(g)+O2(g)?2SO3(g),这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率和提高SO2的转化率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度不变 | |
| C. | 达到平衡时,v(SO2)正=v(O2)逆 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
6.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | A和B都是元素周期表的主族金属元素,B的最高价氧化物的水化物能被A的最高价氧化物的水化物溶解 | |
| D. | A原子最外层电子数比B原子的最外层电子数少 |
5.下列说法中,不正确的是( )
| A. | 非极性键也可能存在于离子化合物中 | |
| B. | 非金属原子及其阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 共价化合物在液态时不能导电 | |
| D. | 双原子分子中的共价键,一定是非极性键 |
4.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )

0 172057 172065 172071 172075 172081 172083 172087 172093 172095 172101 172107 172111 172113 172117 172123 172125 172131 172135 172137 172141 172143 172147 172149 172151 172152 172153 172155 172156 172157 172159 172161 172165 172167 172171 172173 172177 172183 172185 172191 172195 172197 172201 172207 172213 172215 172221 172225 172227 172233 172237 172243 172251 203614

| A. | 该反应为放热反应 | B. | 该反应为吸热反应 | ||
| C. | 该反应只有在加热条件下才能进行 | D. | D物质的能量一定比A物质的能量高 |

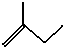
 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷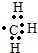 ②氢氧根离子
②氢氧根离子
 .
.