题目内容
13.有机反应中有很多相同反应物因温度不同而产物不同的现象,试写出一例.(写出相应方程式即可)CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O、2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O.分析 CH3CH2OH在不同温度下可发生消去反应,可发生取代反应,以此来解答.
解答 解:CH3CH2OH在170℃可发生消去反应,该反应为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
在140℃发生取代反应生成乙醚,该反应为2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O、2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握常见有机物的性质是解答本题的关键,注意反应类型及温度,题目难度不大.

练习册系列答案
相关题目
3.下列化学方程式或相应的描述涉及的反应与相应的反应类型不一致的是( )
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O 氧化反应 | |
| B. | 苯中加入溴水,充分振荡静置,溴水褪色 取代反应 | |
| C. | nCH2═CHCl$\stackrel{催化剂}{→}$ 加聚反应 加聚反应 | |
| D. | CH2═CH2+Br2→CH2BrCH2Br 加成反应 |
4.化学实验室所用的药品,在使用时,一定要严格遵照有关规定和操作规程,保证安全.如果不慎碰倒酒精灯,洒出的酒精在桌上燃烧起来,你采取的应急措施是( )
| A. | 拨打火警电话119 | B. | 用湿抹布扑盖 | ||
| C. | 找老师一起想办法 | D. | 逃跑 |
18.下列标有横线的物质在给定条件下能完全溶解的是( )
| A. | 常温下,1mol Zn与含1mol浓硫酸反应 | |
| B. | 加热条件下,1mol Cu与含2mol浓硫酸反应 | |
| C. | 常温下,1mol Cu与含4mol浓硝酸反应 | |
| D. | 加热条件下,1mol MnO2与含4mol浓盐酸反应 |
5.既含有极性共价键又含有非极性共价键的物质是( )
| A. | 甲烷 | B. | 乙烷 | C. | 水 | D. | 氧气. |
2.如图是某含C、H、O、N四种元素的有机分子的球棍模型.下列有关该有机物的说法错误的是( )
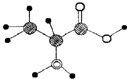

| A. | 其结构简式为:CH3CH(NH2)COOH | |
| B. | 该有机物含有两种官能团 | |
| C. | 该有机物的核磁共振氢谱显示7个吸收峰 | |
| D. | 该有机物能跟NaHCO3溶液反应产生CO2气体 |
 .
.