题目内容
11.根据要求填空:(1)写出下列有机物的键线式:

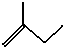
(2)写出有机物
 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷(3)写出下列原子团的电子式:①甲基
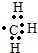 ②氢氧根离子
②氢氧根离子
(4)在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”.写出C7H16的同分异构体中具有“手性碳原子”的结构简式CH3CH2CH(CH3)CH2CH2CH3(或(CH3)2CHCH(CH3)CH2CH3)..
分析 (1)键线式的画法:画出除碳-氢键外的所有化学键;通常所有的氢原子及碳-氢键均省略不画,碳原子用相邻的线的交点表示,一般情况下不用注明.单键用线段表示,双键和叁键分别用平行的两条和三条线表示.对碳原子而言,单键/双键之间键角为120°,涉及三键的键角为180°.氢原子数可根据碳为四价的原则而相应地在碳上补充.
根据键线式的画法画出有机物的键线式.
(2)根据有机物的键线式的表示方法判断该有机物的结构,然后根据烷烃的命名方法命名.
(3)根据离子和甲基的书写方法书写电子式;
(4)根据手性碳原子的概念写出C7H16的同分异构体中其中一个具有“手性碳原子”的结构简式.
解答 解:(1)2-甲基1-丁烯的键线式为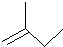 .
.
故答案为: .
.
(2)该有机物中最长的碳链上有7的碳原子属于庚烷,离甲基最近的碳原子为1号碳原子,且要使取代基的序数之和最小,所以该有机物的名称是2,3,5-三甲基-4-乙基庚烷.
故答案为:2,3,5-三甲基-4-乙基庚烷.
(3)甲基中碳原子和三个氢原子形成三个共价键,碳原子还剩一个单电子,所以其电子式为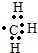 ;氢氧根离子中氧原子和一个氢原子形成一个共价键,氢氧根离子是阴离子要用方括号括起来写上电荷和电性,电子式为
;氢氧根离子中氧原子和一个氢原子形成一个共价键,氢氧根离子是阴离子要用方括号括起来写上电荷和电性,电子式为 .
.
故答案为子式为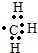 ;
; .
.
(4)根据手性碳原子的概念可知,要使C7H16的同分异构体中具有“手性碳原子”,则其结构简式应该是:CH3CH2CH(CH3)CH2CH2CH3或(CH3)2CHCH(CH3)CH2CH3,其名称分别是3-甲基己烷、2,3-二甲基戊烷,
故答案为:CH3CH2CH(CH3)CH2CH2CH3(或(CH3)2CHCH(CH3)CH2CH3).
点评 本题考查了考查有机物的命名、键线式的书写,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.

| A. | Ca(OH)2+2HCl═CaCl2+H2O | |
| B. | 2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O | |
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | |
| D. | Cl2+H2O═HCl+HClO |
| A. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | A和B都是元素周期表的主族金属元素,B的最高价氧化物的水化物能被A的最高价氧化物的水化物溶解 | |
| D. | A原子最外层电子数比B原子的最外层电子数少 |
①KI溶液 ②淀粉溶液 ③NaOH溶液 ④新制氯水.发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色.依据溶液颜色的变化判断加入以上物质的顺序是( )
| A. | ①→②→③→④ | B. | ①→④→②→③ | C. | ②→④→①→③ | D. | ①→②→④→③ |
| A. | 原气体一定含有NH3、NO、CO2 | |
| B. | 原气体一定不含HBr、NO2、H2 | |
| C. | 原气体中NO与CO2的体积比一定为3:2 | |
| D. | 原气体中NO与CO2的体积比一定为2:3 |
(1)写出G基态原子的电子排布式1s22s22p63s23p63d64s2,G位于周期表d区;画出B基态原子外围电子的电子排布图
 .
.(2)A、B、C的第一电离能由小到大的顺序为C<O<N;电负性由小到大的顺序为C<N<O.(用相应的元素符号表示)
(3)G和Mn(质子数为25)两元素的部分电离能数据列于下表:
| 元素 | Mn | G | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
①Mn基态原子的外围电子排布式为3d54s2,核外电子有25种不同的运动状态,占据7种不同能量的原子轨道.
②比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态G2+再失去一个电子难,对此,合理的解释是?Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+再失去一个电子形成Fe3+的3d轨道电子排布为半满状态较稳定?.