4.过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数如表.
合成过氧化尿素的流程及反应器的示意图如下
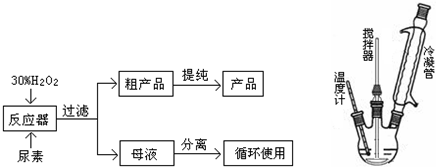
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 500g•L-1 |

请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
3.X、Y、Z、W、M是五种短周期主族元素,它们的核电荷数依次增大.其中X和W同主族,W原子的电子数等于Y和Z的最外层电子数之和,Z2-和M3+具有相同的电子层结构.下列说法正确的是( )
| A. | X、Y、Z形成的化合物中不可能既有离子键 | |
| B. | X和Z、M和Y、Z和W均可形成原子个数比为1:1的化合物 | |
| C. | Y、Z、W、M形成的简单离子半径大小关系为Y>Z>M>W | |
| D. | W与Cl形成化合物的熔点低于M与Cl形成化合物的熔点 |
2.(1)选择下列某种答案的序号,填入下表的空格
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
(2)现有下列各化合物:
A.CH3CH2CH2CHO与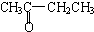 B.
B.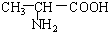 与
与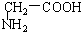 C.
C.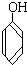 与
与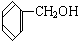
D.CH3CH2C≡CH与CH2═CH-CH=CH2E. 与
与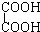 F、戊烯和环戊烷
F、戊烯和环戊烷
①上述化合物中的含氧官能团是(写名称)醛基;羰基;羧基;根据官能团的特点可将C中两化合物划分为酚类和醇类.
②若将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质 名称 | 红磷 与白磷 | 庚烷与 十六烷 | 氯仿与 三氯甲烷 | 氕与 氘、氚 | 2--甲基戊烷与 2,3--二甲基丁烷 |
| 相互 关系 |
A.CH3CH2CH2CHO与
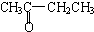 B.
B.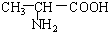 与
与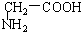 C.
C. 与
与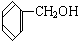
D.CH3CH2C≡CH与CH2═CH-CH=CH2E.
 与
与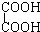 F、戊烯和环戊烷
F、戊烯和环戊烷①上述化合物中的含氧官能团是(写名称)醛基;羰基;羧基;根据官能团的特点可将C中两化合物划分为酚类和醇类.
②若将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
1.化学式为C4H8O2的有机物和稀H2SO4溶液共热可得到有机物A、B,将A氧化最终可得C,且B和C为同系物,若C能发生银镜反应,则原有机物的结构简式为( )
| A. | HCOOCH2CH2CH3 | B. | CH3CH2COOCH3 | C. | CH3COOCH2CH3 | D. | HCOOCH(CH3)2 |
20.工业上由辉铜矿(主要成分为Cu2S)生产铜的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,则下列说法正确的是( )
| A. | Cu2S只作还原剂,O2只作氧化剂 | B. | Cu2S中Cu的化合价为+2价 | ||
| C. | 每生成1molSO2,转移电子6mol | D. | 每生成2molCu,转移电子2mol |
19.下列离子方程式正确的是( )
| A. | 金属铝溶于NaOH溶液:Al+4OH-=[Al(OH)4]- | |
| B. | 向AlCl3溶液中加入足量氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ | |
| C. | Na2SiO3溶液中通入过量CO2:CO2+H2O+SiO32-=H2SiO3↑+CO32- | |
| D. | 向Na[Al(OH)4]溶液中加入过量的盐酸:[Al(OH)4]-+4H+=Al3++4H2O |
18.研究人员研制利用软锰矿浆(主要成分是MnO2)吸收流酸厂的尾气SO2,制备流酸锰的生产流程如下:
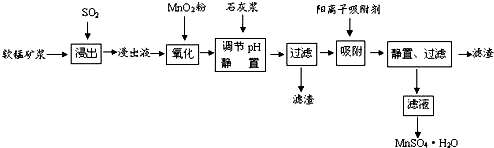
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.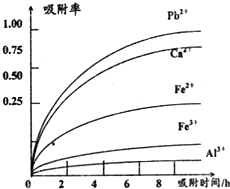
请回答下列问题:
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+,等 其他金属离子,PbO2的氧化性大于MnO2,PbSO4是一种微溶物质.有关金属离子的半径、形成 氢氧化物沉淀时的pH见如表,阳离子吸附剂吸附金属离子的效果见如图.

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成反应的化学方程式SO2+MnO2=MnSO4.
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计,应调节pH的范围为4.7≤pH<8.3.
(4)阳离子吸附剂可用于除去杂质金属离子•请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径、金属离子的电荷等;吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2
mol•L-1Na2SO4溶液等体积混合 (忽略体积的变化),则生成沉淀时,c的最小值是1.82×10-3mol•L-1.
15.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同(a,b,c,d为元素的核内质子数),则下关系正确的是( )
0 171855 171863 171869 171873 171879 171881 171885 171891 171893 171899 171905 171909 171911 171915 171921 171923 171929 171933 171935 171939 171941 171945 171947 171949 171950 171951 171953 171954 171955 171957 171959 171963 171965 171969 171971 171975 171981 171983 171989 171993 171995 171999 172005 172011 172013 172019 172023 172025 172031 172035 172041 172049 203614
| A. | a-b=m-n | B. | b-d=m-n | C. | c-d=m+n | D. | a-b=n-m |
