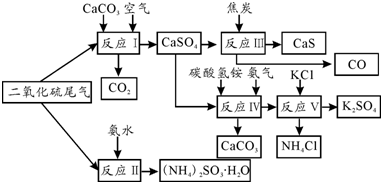
题目内容
2.(1)选择下列某种答案的序号,填入下表的空格①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质 名称 | 红磷 与白磷 | 庚烷与 十六烷 | 氯仿与 三氯甲烷 | 氕与 氘、氚 | 2--甲基戊烷与 2,3--二甲基丁烷 |
| 相互 关系 |
A.CH3CH2CH2CHO与
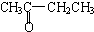 B.
B.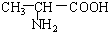 与
与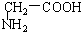 C.
C.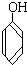 与
与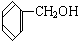
D.CH3CH2C≡CH与CH2═CH-CH=CH2E.
 与
与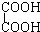 F、戊烯和环戊烷
F、戊烯和环戊烷①上述化合物中的含氧官能团是(写名称)醛基;羰基;羧基;根据官能团的特点可将C中两化合物划分为酚类和醇类.
②若将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
分析 (1)具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;
由同种元素形成的不同单质互为同素异形体;
具有相同分子式而结构不同的化合物互为同分异构体;
同系物是结构相似、分子组成上相差一个或多个某种原子团的化合物;
具有相同化学式和相同结构的为同种物质.
(2)①根据有机物的结构判断含氧官能团;C组含有酚羟基、醇羟基,据此进行分类;
②烯烃被酸性高锰酸钾氧化,C=C水解断裂为C=O双键,据此判断.
解答 解:(1)由同素异形体是同种元素形成的不同单质,则红磷与白磷互为同素异形体;
由同系物是有机化合物中具有同一通式、组成上相差一个或多个某种原子团、在结构与性质上相似的化合物系列,则庚烷与十六烷、新戊烷互为同系物;
三氯甲烷俗称氯仿,故三氯甲烷和氯仿是同种物质;
由具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,即氕与氘、氚互为同位素;
由具有相同分子式而结构不同的化合物互为同分异构体,则丁烷与2--甲基丙烷、2--甲基戊烷与2,3--二甲基丁烷互为同分异构体;
故答案为:②,④,⑤,①,③;
(2)①上述化合物中含有的含氧官能团为:醛基、酮羰基、羧基、酚羟基、醇羟基;
C组中前者为苯酚,含有酚羟基,属于酚类.后者为苯甲醇,含有醇羟基,属于醇类,
故答案为:醛基;羰基;羧基;酚;醇;
②将A中两化合物看作是某单烯烃被酸性高锰酸钾溶液氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3,
故答案为:CH3CH2CH2CH=C(CH3)CH2CH3.
点评 本题考查同系物、同分异构体、官能团结构、有机物分类、烯烃的性质等,难度不大,注意理解把握同系物、同分异构体的内涵与外延,注意掌握常见有机物的结构与性质.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
13.下列物质中能与烧碱溶液发生氧化还原反应的是( )
| A. | CuSO4 | B. | SiO2 | C. | NH4Cl | D. | Al |
10.下列说法正确的是( )
| A. | 碱土金属元素是 IA 族元素 | B. | 被称为“生命元素”的是15号元素P | ||
| C. | 稀有气体元素都是非金属元素 | D. | 氕、氘、氚均可用做制造氢弹的原料 |
14.在5L物质的量浓度为2mol/l的K2SO4溶液中K+的物质的量浓度为( )
| A. | 2mol/l | B. | 4mol/l | C. | 1 mol/l | D. | 20mol/l |
11.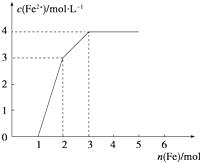 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则稀溶液中Fe(NO3)3、HNO3、Cu(NO3)2物质的量浓度之比为( )(已知氧化性顺序:HNO3>Fe(NO3)3>Cu(NO3)2)| A. | 1:1:1 | B. | 1:4:1 | C. | 3:3:8 | D. | 1:1:4 |
12.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 1mol甲烷在光照条件下最多能与89.6L氯气反应 | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: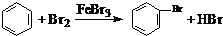 |