题目内容
16.玻璃和水泥用的相同原料是石灰石,普通玻璃的主要成分是硅酸钠、硅酸钙、二氧化硅,
玻璃制取时的化学方程式:Na2CO3+SiO2═Na2SiO3+CO2↑、CaCO3+SiO2═CaSiO3+CO2↑.
分析 制造玻璃用的原料是:石灰石、纯碱、二氧化硅;制造水泥的原料是:石灰石和黏土;
依据玻璃的主要成分解答;
制备玻璃时发生反应为:碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,碳酸钙与二氧化硅反应生成硅酸钙和二氧化碳.
解答 解:造玻璃用的原料是:石灰石、纯碱、二氧化硅;制造水泥的原料是:石灰石和黏土;
所以二者都用到的原料是:石灰石;
故答案为:石灰石;
普通玻璃的主要成分是:硅酸钠、硅酸钙、二氧化硅;
故答案为:硅酸钠、硅酸钙、二氧化硅;
制备玻璃时发生反应为:碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,化学方程式:Na2CO3+SiO2═Na2SiO3+CO2↑;
碳酸钙与二氧化硅反应生成硅酸钙和二氧化碳,化学方程式:CaCO3+SiO2═CaSiO3+CO2↑;
故答案为:Na2CO3+SiO2═Na2SiO3+CO2↑;CaCO3+SiO2═CaSiO3+CO2↑.
点评 本题考查了玻璃、水泥的制备,熟悉制备原理、使用原料是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列说法正确的是( )
| A. | 木炭在空气中燃烧发白光、放热 | |
| B. | 氧化反应是指物质与氧气发生的化合反应 | |
| C. | 凡是在空气中不能燃烧的物质,在纯氧中也不能燃烧 | |
| D. | 蜡烛燃烧、食物腐败都是氧化反应 |
4.下列有关说法正确的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锌铁皮镀层受损后,铁比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)增大 | |
| D. | 一定条件下水由气态变为液态是熵增加的过程 |
11.苯甲酸广泛用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
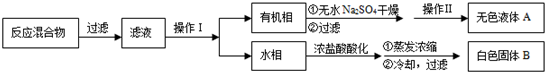
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数的计算表达为$\frac{2.4×10{\;}^{-3}mol×4×122g/mol}{1.22g}$,计算结果为96%(保留二位有效数字).

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
1.化学式为C4H8O2的有机物和稀H2SO4溶液共热可得到有机物A、B,将A氧化最终可得C,且B和C为同系物,若C能发生银镜反应,则原有机物的结构简式为( )
| A. | HCOOCH2CH2CH3 | B. | CH3CH2COOCH3 | C. | CH3COOCH2CH3 | D. | HCOOCH(CH3)2 |
5.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 13.8 g N02与足量水反应,转移电子数目为0.2 NA | |
| B. | 标准状况下,22.4 L溴苯中含有氢原子数目为5NA | |
| C. | 500 mL 2 mol/L NH4N03溶液中,含有NH4+数目为NA | |
| D. | 用惰性电极电解足量CuS04溶液,生成22.4 L气体时转移电子数目为4 NA |
6.亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2═LiNH2+LiH下列说法正确的是( )
| A. | 亚氨基锂(Li2NH)中N的化合价为-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | Li+和H-的半径相同 | |
| D. | 该反应中氢气既是氧化剂又是还原剂 |
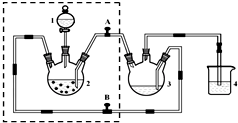 醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: