题目内容
19.下列离子方程式正确的是( )| A. | 金属铝溶于NaOH溶液:Al+4OH-=[Al(OH)4]- | |
| B. | 向AlCl3溶液中加入足量氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ | |
| C. | Na2SiO3溶液中通入过量CO2:CO2+H2O+SiO32-=H2SiO3↑+CO32- | |
| D. | 向Na[Al(OH)4]溶液中加入过量的盐酸:[Al(OH)4]-+4H+=Al3++4H2O |
分析 A.电荷不守恒,不符合反应客观事实;
B.一水合氨为弱电解质,应保留化学式;
C.二氧化碳过量反应生成硅酸沉淀、碳酸氢钠;
D.盐酸过量反应生成氯化铝和水.
解答 解:A.金属铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故A错误;
B.向AlCl3溶液中加入足量氨水制备Al(OH)3,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.Na2SiO3溶液中通入过量CO2,离子方程式:2CO2+2H2O+SiO32-=H2SiO3↑+2HCO3-,故C错误;
D.向Na[Al(OH)4]溶液中加入过量的盐酸,离子方程式:[Al(OH)4]-+4H+=Al3++4H2O,故D正确;
故选:D.
点评 本题考查了离子方程式书写,明确发生的化学反应及离子反应的书写方法即可解答,注意化学式拆分、注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
14.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在
空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、
Fe2+、Cl-)生产CuCl的流程如下:
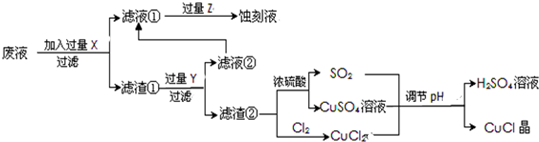
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽.
(2)写出生产过程中XFeYHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤,法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体.
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得:
④数据处理:计算得该工业CuCl的纯度为95%(平行实验结果相差不能超过0.3%)
空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、
Fe2+、Cl-)生产CuCl的流程如下:

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽.
(2)写出生产过程中XFeYHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤,法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体.
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
4.过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数如表.
合成过氧化尿素的流程及反应器的示意图如下
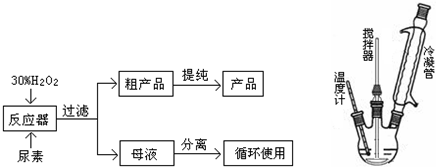
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 500g•L-1 |

请回答下列问题:
(1)写出合成过氧化尿素的化学方程式:CO(NH2)2+H2O2=CO(NH2)2•H2O2.
(2)反应器里冷凝管中冷水从下(填“上”或“下”)口流入;反应器的加热方式是②.
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是铁铝易被(过氧化氢)腐蚀.
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解.
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%).为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
①完成并配平下列化学方程式;
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
②KMnO4溶液应盛放在酸式滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量偏高(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量不合格(填“合格”或“不合格”),活性氧的质量分数为12%..
11.设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| B. | 1L 0.1mol•L-1碳酸钠溶液的阴离子总数等于0.1NA | |
| C. | 室温下pH=13的NaOH溶液中含有的OH-0.1NA | |
| D. | 浓度分别为1mol•L-1和0.5mol•L-1的CH3COOH和CH3COONa混合液共1L,含CH3COOH和CH3COO-共1.5mol |
8.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 原子半径由小到大的顺序为Y<Z<X<W | |
| B. | X的简单氢化物的热稳定性比W的强 | |
| C. | 化合物YX、ZX2、WX3,中化学键的类型相同 | |
| D. | W的最高价氧化物对应水化物的酸性比Z的弱 |

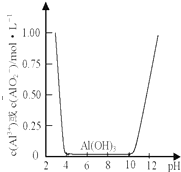 某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.
某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示.
 、CO,你认为其中含量最大的是HCl.
、CO,你认为其中含量最大的是HCl. 某实验需要100mL、0.1mol/L的Na2CO3溶液,现通过如下操作配制:
某实验需要100mL、0.1mol/L的Na2CO3溶液,现通过如下操作配制: