2.一定温度下,在恒容密闭容器中发生如下反应:A(g)+2B(g)?3C(g),若反应开始时充入2molA和1molB,达到平衡后A的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
| A. | 3molC | B. | 1molA,1molB,1molHe | ||
| C. | 2molA,1molC | D. | 2.5molA,0.5molB,1.5molC |
1.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1.0L1.0mo1•L-1的Na2SO4水溶液中含有的氧原子数为4NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 2.3g金属钠与过量的氧气反应,无论是否加热转移电子数均为0.1NA | |
| D. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
20.下列说法正确的是( )
| A. | 焓变单位中kJ•mol-1,是指1 mol物质参加反应时的能量变化 | |
| B. | 反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同 | |
| C. | 一个化学反应中,反应物的总键能大于生成物的总键能时,反应吸热,△H>0 | |
| D. | 一个化学反应中,反应物的总能量小于生成物的总能量时,反应放热,△H<0 |
19.某同学受硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2的启发,提出过量氯气与铁反应生成FeCl3、氯气与过量铁粉反应生成FeCl2的观点.为了验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质A,然后通过实验确定其成分.探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是FeCl3和FeCl2.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(请在表格的横线处填空)
(3)已知 Fe(NO3)2溶液为浅绿色,往Fe(NO3)2溶液中加入少量的稀硫酸,溶液颜色有何变化(请把答案写在横线上)由浅绿色变为黄色,该变化过程的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是CD(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,写出该反应的离子方程式4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
(1)提出假设:(请把下列假设补充完整)
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是FeCl3和FeCl2.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(请在表格的横线处填空)
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是CD(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,写出该反应的离子方程式4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
17.t℃时,A的溶解度是S g/100g,其饱和溶液密度为d g/cm3、物质的量浓度为c mol/L.溶液的质量分数为w,摩尔质量为M g/mol,实验测得向一定量含A的溶液中加入m g无水A或蒸发掉n g水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
| A. | S=$\frac{100n}{m}$ | B. | c=$\frac{1000md}{(m+n)M}$ | C. | S=$\frac{100m}{m+n}$ | D. | c%=$\frac{10S}{100+S}$100% |
16.下列物质的分类结果全部正确的是( )
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 漂白粉-混合物 胆矾-纯净物 HD-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 盐酸-强电解质 硫酸钡-强电解质 醋酸-弱电解质 |
15.下列关于溶液中微粒的浓度说法正确的是( )
0 171721 171729 171735 171739 171745 171747 171751 171757 171759 171765 171771 171775 171777 171781 171787 171789 171795 171799 171801 171805 171807 171811 171813 171815 171816 171817 171819 171820 171821 171823 171825 171829 171831 171835 171837 171841 171847 171849 171855 171859 171861 171865 171871 171877 171879 171885 171889 171891 171897 171901 171907 171915 203614
| A. | O.1 mol•L-1 的 NaHSO3 溶液(pH<7)中:c(H+)+c(H2SO3)=c(SO${\;}_{3}^{2-}$)+c(OH-) | |
| B. | 0.1mol.L-1的(NH4)2S04,溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | 物质的量浓度均为0.1 mol•L-1丨的Na2CO3与HCl溶液等体积混合<忽略体积变化): $\frac{1}{2}$c(Na+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(H2CO3)=0.1 mol.L-1 | |
| D. | 物质的量浓度均为0.1 mol•L-1的NH4Cl、氨水混合溶液中:c(NH${\;}_{4}^{+}$)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
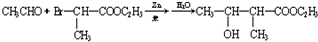 ,
, 通过以下路线可合成(G):
通过以下路线可合成(G):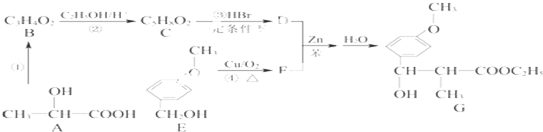
 .
.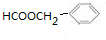 .
.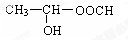 .
.