题目内容
13.(1)某银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B;将A在空气中露置,最后变成白色固体C,将A、B投入水中都生成D.则A是Na;B是Na2O2;C是Na2O;D是NaOH.
B与H2O反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
B与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑.
(2)有A、B、C三种无色溶液,已知是HCl、H2SO4、Ba(NO3)2三种物质的溶液中的一种,按一定顺序滴入Na2CO3溶液中,至恰好完全反应,有以下现象:
①加入A时有白色沉淀.
②向 ①中沉淀加入B时,沉淀溶解,并有气体逸出.
③向②中生成的溶液中加入C时,又有白色沉淀生成.根据以上现象,回答下列问题:
判断A、B、C 各是什么溶液?ABa(NO3)2,BHCl,CH2SO4.
写出相关的离子方程式:Ba2++CO32-=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;Ba2++SO42-=BaSO4↓.
(3)将氢氧化钡溶液与硫酸铜溶液混合,反应的离子方程式为Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓.
分析 (1)由银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B,则B为Na2O2,A为Na;由将A在空气中露置,最后变成白色固体C,则C为Na2O,由A、B投入水中都生成D,D为NaOH,以此来解答;
(2)①加入A时生成白色沉淀,三种溶液中只有钡离子能和碳酸根离子反应生成白色沉淀,所以A是硝酸钡,②往①中沉淀加入B时沉淀溶解,并有气体逸出,③往②中生成的溶液中加入C时,又有白色沉淀生成,硫酸和碳酸钡反应生成硫酸钡和二氧化碳,盐酸和碳酸钡反应只有气体生成,所以B是盐酸,C是硫酸;
(3)硫酸铜溶液和氢氧化钡溶液反应生成硫酸钡和氢氧化铜.
解答 解:(1)由银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B,则B为Na2O2,A为Na;由将A在空气中露置,最后变成白色固体C,则C为Na2O,由A、B投入水中都生成D,D为NaOH,由上述分析可知:A是Na,B是Na2O2 ,C是Na2O,D是NaOH,B与H2O反应为2Na2O2+2H2O=4NaOH+O2↑,其离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,B与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑,
故答案为:Na;Na2O2 ; Na2O; NaOH;2Na2O2+2H2O=4Na++4OH-+O2↑;2Na2O2+2CO2=2Na2CO3+O2↑;
(2)①加入A时生成白色沉淀,三种溶液中只有钡离子能和碳酸根离子反应生成白色沉淀,所以A是硝酸钡,②往①中沉淀加入B时沉淀溶解,并有气体逸出,③往②中生成的溶液中加入C时,又有白色沉淀生成,硫酸和碳酸钡反应生成硫酸钡和二氧化碳,盐酸和碳酸钡反应只有气体生成,所以B是盐酸,C是硫酸,通过以上分析知,A是 Ba(NO3)2 B是HCl,C是硫酸,①钡离子和碳酸根离子反应生成碳酸钡白色沉淀,离子方程式为Ba2++CO32-=BaCO3↓,②碳酸钡和盐酸反应生成钡离子、二氧化碳和水,离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,③钡离子和硫酸根离子反应生成硫酸钡白色沉淀,离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:Ba(NO3)2;HCl;H2SO4;Ba2++CO32-=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;Ba2++SO42-=BaSO4↓;
(3)硫酸铜溶液和氢氧化钡溶液反应生成硫酸钡和氢氧化铜,离子方程式为:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓,
故答案为:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓.
点评 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物基础知识的灵活运用,题目难度中等.

| A. | 16O2与18O2互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O和18O互为同位素 | |
| D. | 1.12L16O2和 1.12L18O2均含有0.1 NA个氧原子 |
| A. | 配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解 | |
| B. | 配制1mol•L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 取用一小块钠时,将剩余的钠丢进废液缸 |
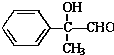 某有机物如图所示,该有机物不可能发生的化学反应是( )
某有机物如图所示,该有机物不可能发生的化学反应是( )①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解.
| A. | ①④ | B. | ⑦ | C. | ②⑤ | D. | ②⑦ |
| A. | 石膏能使豆浆变成豆腐 | |
| B. | 明矾净水 | |
| C. | 花粉在水面上做布朗运动 | |
| D. | 太阳光照在弥漫灰尘的室内,可看到从窗口到地面出现一条光亮的通路 |


 (1)装置 I中的浓硫酸不能(能或不能)用稀硫酸代替,原因是二氧化硫易溶于水,故不能用稀硫酸.
(1)装置 I中的浓硫酸不能(能或不能)用稀硫酸代替,原因是二氧化硫易溶于水,故不能用稀硫酸.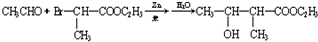 ,
, 通过以下路线可合成(G):
通过以下路线可合成(G):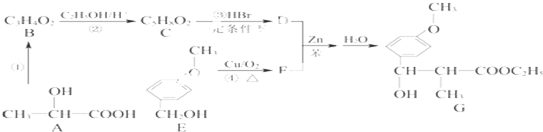
 .
.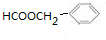 .
.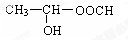 .
.