题目内容
15.下列关于溶液中微粒的浓度说法正确的是( )| A. | O.1 mol•L-1 的 NaHSO3 溶液(pH<7)中:c(H+)+c(H2SO3)=c(SO${\;}_{3}^{2-}$)+c(OH-) | |
| B. | 0.1mol.L-1的(NH4)2S04,溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| C. | 物质的量浓度均为0.1 mol•L-1丨的Na2CO3与HCl溶液等体积混合<忽略体积变化): $\frac{1}{2}$c(Na+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(H2CO3)=0.1 mol.L-1 | |
| D. | 物质的量浓度均为0.1 mol•L-1的NH4Cl、氨水混合溶液中:c(NH${\;}_{4}^{+}$)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
分析 A.根据亚硫酸氢钠溶液中的电荷守恒、物料守恒判断;
B.铵根离子部分水解,溶液呈酸性,由于水解程度较小,则c(NH4+)>c(SO42-);
C.混合液体积增大一倍,则钠离子浓度变为原先的一半,即:$\frac{1}{2}$c(Na+)=0.05mol/L;
D.一水合氨的电离程大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒c(NH4+)+c(NH3•H2O)=2c(Cl-)可知c(Cl-)>c(NH3•H2O).
解答 解:A.根据物料守恒可知:c(Na+)=c(H2SO3)+c(SO32-)+c(HSO3-),根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),二者结合可得:c(H+)+c(H2SO3)=c(OH-)+c(SO32-),故A正确;
B.0.1mol.L-1的(NH4)2S04溶液中,铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-),由于水解程度较小,则c(NH4+)>c(SO42-),溶液中正确的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故B错误;
C.物质的量浓度均为0.1 mol•L-1丨的Na2CO3与HCl溶液等体积混合<忽略体积变化),根据物料守恒可得:$\frac{1}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)=0.05 mol.L-1,故C错误;
D.物质的量浓度均为0.1 mol•L-1的NH4Cl、氨水混合溶液中,由于一水合氨的电离程大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒c(NH4+)+c(NH3•H2O)=2c(Cl-)可知c(Cl-)>c(NH3•H2O),所以溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理危机的关键,C为易错点,注意混合液体积的变化情况,试题培养了学生的分析能力及灵活应用能力.

| A. | N2分子的电子式: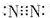 | B. | 乙醇的结构简式:C2H6O | ||
| C. | 镁离子的结构示意图: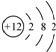 | D. | CO2的比例模型: |
其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于$\frac{5}{6}$mol.
| A. | 稀硫酸滴加在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化镁溶解于盐酸:OH?+H+═H2O | |
| C. | 金属铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 铜和硝酸银溶液反应:Cu+2Ag+═2Ag+Cu2+ |
| A. | 焓变单位中kJ•mol-1,是指1 mol物质参加反应时的能量变化 | |
| B. | 反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同 | |
| C. | 一个化学反应中,反应物的总键能大于生成物的总键能时,反应吸热,△H>0 | |
| D. | 一个化学反应中,反应物的总能量小于生成物的总能量时,反应放热,△H<0 |
| A. | 溴苯(液溴):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量溴水溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
| A. | 测得容器内压强增大p%,A的转化率也是p% | |
| B. | 恒容容器内平衡后再充入A(g),此平衡逆向移动 | |
| C. | 恒容容器内平衡后再充入等量的A(g),达到新平衡后,容器内压强p’为原平衡容器压强p的2倍 | |
| D. | 恒压容器内平衡后再充入Ar(g),A的转化率不变 |
| A. | CH4 | B. | C3H8 | C. | C10H20 | D. | C5H12 |
