8.下列各原子或离子的电子排列式错误的是( )
| A. | Na+ 1s22s22p6 | B. | F 1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O2- 1s22s22p6 |
7. 如图是某学校实验室买回的硫酸试剂标签上的部分内容,据此判断下列说法正确的是( )
如图是某学校实验室买回的硫酸试剂标签上的部分内容,据此判断下列说法正确的是( )
 如图是某学校实验室买回的硫酸试剂标签上的部分内容,据此判断下列说法正确的是( )
如图是某学校实验室买回的硫酸试剂标签上的部分内容,据此判断下列说法正确的是( )| A. | 该硫酸的浓度为18.4mol•L-1 | |
| B. | 配制200mL 4.6mol•L-1的稀硫酸需该硫酸50mL | |
| C. | 配制100g10%的硫酸需要用到的仪器有胶头滴管、烧杯、玻璃棒、100mL量筒、天平 | |
| D. | 稀释该浓硫酸时可直接把水加入浓硫酸中 |
6.2NO2(g)?N2O4(g)达到平衡后下列条件的改变可使NO2气体浓度增大的是( )
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
4.下列说法正确的是( )
| A. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 | |
| B. | 石油的分馏、煤的液化、汽化都是物理变化 | |
| C. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可以发生水解反应 |
2.微型银锌电池钮扣电池有广泛应用,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是( )
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的碱性增强 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
1.(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
则X、Y、Z的电负性从大到小的顺序为Al>Mg>Na(用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定.
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
②M是含有极性键(填“极性”或“非极性”)的非极性分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,因而易液化.
④W分子的VSEPR模型的空间构型为四面体形,W分子的空间构型为V形.
⑤AB-离子中和B2分子的π键数目比为1:1.
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为+6.
②G2+离子的核外电子排布式为1s22s22p63s23p63d9,G2+和N分子形成的配离子的结构式为 .
.
0 171656 171664 171670 171674 171680 171682 171686 171692 171694 171700 171706 171710 171712 171716 171722 171724 171730 171734 171736 171740 171742 171746 171748 171750 171751 171752 171754 171755 171756 171758 171760 171764 171766 171770 171772 171776 171782 171784 171790 171794 171796 171800 171806 171812 171814 171820 171824 171826 171832 171836 171842 171850 203614
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
②M是含有极性键(填“极性”或“非极性”)的非极性分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,因而易液化.
④W分子的VSEPR模型的空间构型为四面体形,W分子的空间构型为V形.
⑤AB-离子中和B2分子的π键数目比为1:1.
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为+6.
②G2+离子的核外电子排布式为1s22s22p63s23p63d9,G2+和N分子形成的配离子的结构式为
 .
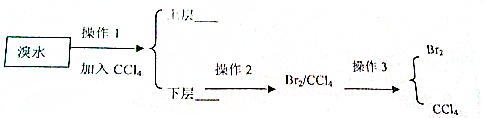
. 
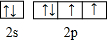 ,该元素的名称是氧;
,该元素的名称是氧;