10.一定温度下,体积为1L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表所示:
下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.4 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.1 | 0.2 |
| A. | 反应可表示为X+3Y?2Z,其平衡常数为400 | |
| B. | 向该容器中再加入0.1mol X、0.1mol Y、0.2mol Z,平衡不移动 | |
| C. | 若向容器中再加入0.1mol X,因平衡向右移动,则X、Y、Z的转化率均增大 | |
| D. | 若升高温度时,Z的浓度增大,则容器内的压强增大 |
9.下列说法中正确的是( )
| A. | 勒夏特列原理不能用于判断反应是否达平衡状态 | |
| B. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| C. | 能自发进行的反应其速率都很大 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
8.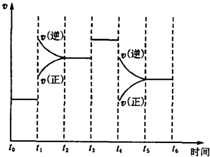 已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )
已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )
 已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )
已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )| A. | t2~t3 | B. | t0~t1 | C. | t4~t5 | D. | t6~t7 |
7.等物质的量的PCl5(g)分别放入起始体积相同的恒压容器A和恒容容器B中,相同温度下反应:PCl5(g)?PCl3(g)+Cl2(g)达到平衡时,两容器中PCl5的分解率相比(用X表示)( )
| A. | XA>XB | B. | XA<XB | C. | XA=XB | D. | 无法确定 |
6.现由含硫酸钠、氯化镁、氯化钙和泥沙等杂质的粗食盐提纯氯化钠,可将粗食盐溶于水,然后进行下列操作:①过滤②加过量氢氧化钠溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥蒸发结晶;正确的操作顺序是( )
| A. | ①②④⑤③⑥ | B. | ①⑤④②①③⑥ | C. | ①⑤④②③⑥ | D. | ①②④⑤①③⑥ |
5.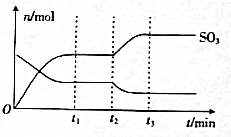 工业生产硫酸的一个重要反应为为2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1.如图表示反应在t1时达到平衡,t2时改变条件,在t3时又重新达到平衡,t2时改变的条件(假设只改变一个条件,其他条件不变)可以是( )
工业生产硫酸的一个重要反应为为2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1.如图表示反应在t1时达到平衡,t2时改变条件,在t3时又重新达到平衡,t2时改变的条件(假设只改变一个条件,其他条件不变)可以是( )
 工业生产硫酸的一个重要反应为为2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1.如图表示反应在t1时达到平衡,t2时改变条件,在t3时又重新达到平衡,t2时改变的条件(假设只改变一个条件,其他条件不变)可以是( )
工业生产硫酸的一个重要反应为为2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1.如图表示反应在t1时达到平衡,t2时改变条件,在t3时又重新达到平衡,t2时改变的条件(假设只改变一个条件,其他条件不变)可以是( )| A. | 减小压强 | B. | 升高反应体系温度 | ||
| C. | 使用新型催化剂 | D. | 加入SO2 |
4.某同学从自家厨房找到一些被大量花生油污染的粗盐固体,此粗盐中还混有 Mg2+、Ca2+、SO42-等杂质,该同学欲将该粗盐提纯,得到纯净的氯化钠固体.请你帮助他从以下操作中选择正确操作和顺序 ( )
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
0 171635 171643 171649 171653 171659 171661 171665 171671 171673 171679 171685 171689 171691 171695 171701 171703 171709 171713 171715 171719 171721 171725 171727 171729 171730 171731 171733 171734 171735 171737 171739 171743 171745 171749 171751 171755 171761 171763 171769 171773 171775 171779 171785 171791 171793 171799 171803 171805 171811 171815 171821 171829 203614
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
| A. | ②⑤④①③ | B. | ⑧④①②⑤③⑦ | C. | ⑧⑥②⑤④①③⑦ | D. | ⑧②④⑤①⑥③⑦ |
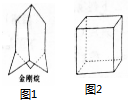 金刚烷、立方烷的合成在有机合成史上具有理论意义.
金刚烷、立方烷的合成在有机合成史上具有理论意义.