题目内容
7.等物质的量的PCl5(g)分别放入起始体积相同的恒压容器A和恒容容器B中,相同温度下反应:PCl5(g)?PCl3(g)+Cl2(g)达到平衡时,两容器中PCl5的分解率相比(用X表示)( )| A. | XA>XB | B. | XA<XB | C. | XA=XB | D. | 无法确定 |
分析 恒压容器A中,随着反应正向进行,气体的总物质的量增大,容器体积增大,可以先假设A容器恒容反应,作为过渡,则过渡态与B容器反应结果相同,然后再将A容器体积增大(相当于减压),则平衡再正向移动.
解答 解:等物质的量的PCl5(g)分别放入起始体积相同的恒压容器A和恒容容器B中,相同温度下反应:PCl5(g)?PCl3(g)+Cl2(g)达到平衡时,恒压容器中体积增大,压强减小,平衡正向进行,两容器中PCl5的分解率相比XA>XB,
故选A.
点评 本题考查了化学平衡的建立和影响因素的分析判断,掌握基础和平衡移动原理的实质分析是解题关键,题目难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
17.X、Y、Z、W为四种短周期元素,它们的性质、原子结构等信息如表:
回答下列问题:
(1)W在元素周期表中的位置是第三周期第ⅦA 族.X、Y、W三种元素的简单离子半径大小是S2->Cl->Na+;(用离子符号表示)
(2)Y单质在氧气中燃烧的产物的电子式为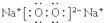 .用电子式表示元素X与Y形成化合物的过程
.用电子式表示元素X与Y形成化合物的过程 ;
;
(3)Z的气态氢化物的沸点反常,原因是NH3分子间存在氢键.元素W与元素X相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②④;
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
④W的单质可以和X的氢化物水溶液反应置换出X
(4)Z2在一定条件下能和氢气反应生成气态氢化物,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1molZ2中的化学键消耗的能量为Q2kJ,形成1molZ-H化学键释放的能量为O3kJ,则上述反应放出的能量可表示为6Q3-3Q1-Q2kJ.
| X | 原子M层上的电子数是原子核外电子层数的2倍 |
| Y | 短周期中原子半径最大的元素 |
| Z | 元素的单质为双原子分子,Z的氢化物水溶液呈碱性 |
| W | 元素最高正价是+7价 |
(1)W在元素周期表中的位置是第三周期第ⅦA 族.X、Y、W三种元素的简单离子半径大小是S2->Cl->Na+;(用离子符号表示)
(2)Y单质在氧气中燃烧的产物的电子式为
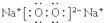 .用电子式表示元素X与Y形成化合物的过程
.用电子式表示元素X与Y形成化合物的过程 ;
;(3)Z的气态氢化物的沸点反常,原因是NH3分子间存在氢键.元素W与元素X相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②④;
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
④W的单质可以和X的氢化物水溶液反应置换出X
(4)Z2在一定条件下能和氢气反应生成气态氢化物,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1molZ2中的化学键消耗的能量为Q2kJ,形成1molZ-H化学键释放的能量为O3kJ,则上述反应放出的能量可表示为6Q3-3Q1-Q2kJ.
18.下列叙述正确的是( )
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)>c(CHCOO-)>c(H+)=c(OH-) | |
| B. | 0.1mol/LKHS的溶液中,c(K+)═2c(S2-)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者 | |
| D. | 中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |
12.下列表示对应化学反应的离子方程式或化学方程式正确的是( )
| A. | 向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO+CO2+3H2O═2Al(OH)3↓+CO | |
| D. | 以下有机物在碱性条件下水解的化学方程式: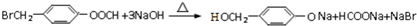 |
19.下列说法正确的是( )
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮咬能够引起铅中毒 | |
| B. | 酸雨形成的主要原因是汽车尾气的任意排放 | |
| C. | 维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好 | |
| D. | 淀粉、纤维素,、蛋白质和油脂均属于天然高分子化合物 |
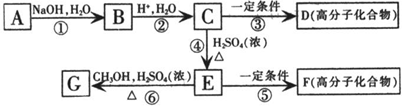
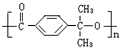 ;
;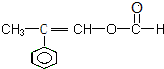 、
、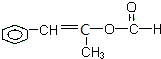 、
、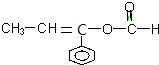 ;
;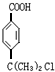 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +NaCl+2H2O.
+NaCl+2H2O.
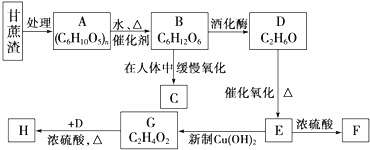
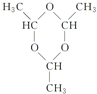 .
.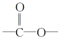 ”结构的链状同分异构体最多有5种(不含H).写出H的不同种类的任意两种同分异构体的结构简式HCOOCH2CH2CH3、CH3CH2CH2COOH.
”结构的链状同分异构体最多有5种(不含H).写出H的不同种类的任意两种同分异构体的结构简式HCOOCH2CH2CH3、CH3CH2CH2COOH.