题目内容
9.下列说法中正确的是( )| A. | 勒夏特列原理不能用于判断反应是否达平衡状态 | |
| B. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| C. | 能自发进行的反应其速率都很大 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
分析 A、勒夏特列原理只能判断外界条件改变对平衡移动的影响;
B、浓度、压强的改变不影响分子的能量和活化能;
C、反应自发进行与否与化学反应速率无关;
D、相同物质的量的C完全燃烧放出的热量大于不完全燃烧生成CO放出的热量.
解答 解:A、勒夏特列原理只能判断外界条件改变对平衡移动的影响,不能判断反应是否达到平衡状态,故A正确;
B、浓度、压强的改变不能改变活化分子百分数,催化剂和温度能够改变活化分子百分数,故B错误;
C、反应自发进行是反应能否发生的可能性,反应速率不一定快,故C错误;
D、C燃烧的焓变为负值,放热越多,焓变越小,所以2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2,故D错误;
故选A.
点评 本题考查了勒夏特列原理的含义、活化分子百分数改变的判断、反应自发进行与反应速率的关系、焓变大小比较,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.将一定量的BaSO4放入水中,对此有关的叙述正确的是( )
| A. | BaSO4不溶于水,所以BaSO4固体质量不会减少 | |
| B. | BaSO4的电离方程式为:BaSO4?Ba2++SO42- | |
| C. | 加水或加入Na2SO4溶液,Ksp不变,沉淀溶解平衡不移动 | |
| D. | 体系中存在平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) |
17.下列化学反应的离子方程式正确的是( )
| A. | 铯与水反应:Cs+H2O═Cs++OH-+H2↑ | |
| B. | 实验室检验氯气:Cl2+2I-═I2+2Cl- | |
| C. | 实验室制氨气:NH4++OH-═H2O+NH3↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
4.某同学从自家厨房找到一些被大量花生油污染的粗盐固体,此粗盐中还混有 Mg2+、Ca2+、SO42-等杂质,该同学欲将该粗盐提纯,得到纯净的氯化钠固体.请你帮助他从以下操作中选择正确操作和顺序 ( )
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
| A. | ②⑤④①③ | B. | ⑧④①②⑤③⑦ | C. | ⑧⑥②⑤④①③⑦ | D. | ⑧②④⑤①⑥③⑦ |
14.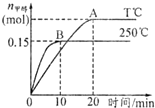 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).
根据右图,下列分析中正确的是( )
 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).根据右图,下列分析中正确的是( )
| A. | 250°C时,反应在前10 s 的平均速率v(H2)=0.015 mol/(L.min) | |
| B. | 平衡时CO的转化率:250°C>T0C | |
| C. | 反应达平衡后,其他条件不变,若减小容积体积,CO体积分数增大 | |
| D. | 该反应的正反应是放热反应 |
1.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | R与T形成的化合物RT3中,各原子均满足8电子的稳定结构 | |
| B. | 单质与稀盐酸反应产生氢气的剧烈程度为L<Q | |
| C. | M与T形成的化合物具有两性 | |
| D. | L2+与R2-的核外电子数相等 |
18.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 氮的固定是指将气态氮气变为固态 | |
| B. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| C. | 金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属” | |
| D. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |
 ;
;