题目内容
2.下面是科学家发现或合成的部分形状奇特的有机物分子.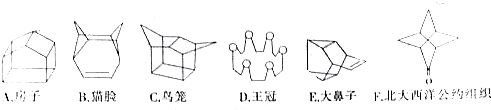
根据上述分子的结构,回答下列问题:
(1)上述表示有机物结构的图形称为键线式,F分子中官能团的名称是羰基.
(2)上述有机物中,属于烃的是ABCE(填字母,下同);能使溴水因发生化学反应而褪色的是BE.
(3)A的分子式为C10H10,C的核磁共振氢谱中共有4个峰.
(4)1 mol D完全燃烧消耗的氧气在标准状况下的体积为336L.
分析 (1)只用键线来表示碳架,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其他杂原子及与杂原子相连的氢原子须保留.每个端点和拐角处都代表一个碳.用这种方式表示的结构式为键线式.F含有羰基;
(2)烃是指仅含碳氢两种元素的化合物,碳碳双键能与溴水反应;
(3)根据结构简式确定分子式;根据有机物分子中有几种H原子,核磁共振氢谱有几种吸收峰,结合等效氢判断;
(4)D分子式为C12H24O6,根据燃烧的化学方程式解题.
解答 解:(1)上述表示有机物结构的图形为键线式,F含有-CO-羰基,故答案为:键线式;羰基;
(2)烃是指仅含碳氢两种元素的化合物,ABCE是烃,BE含碳碳双键能与溴水反应,故答案为:ABCE;BE;
(3)A的分子式为C10H10;C中有4种氢原子,核磁共振氢谱中4种峰,故答案为:C10H10;4;
(4)D分子式为C12H24O6,D燃烧的化学方程式:C12H24O6+15O2=12CO2+12H2O,V=nVm=15×22.4=336L,故答案为:336.
点评 本题考查有机物分子式确定、有机物燃烧计算等,难度不大,注意理解掌握等效氢的判断方法.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
12.下列说法正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 非金属元素之间可以形成离子化合物 | |
| C. | 不同元素的原子构成的分子只含极性共价键 | |
| D. | 主族元素的最外层电子数一定等于其最高化合价 |
13.由E转化为对甲基苯乙炔(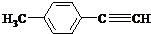 )的一条路线如下:
)的一条路线如下:
已知-CHO可以在催化剂的条件下被氢气还原为-CH2OH
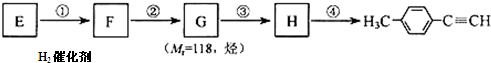
(1)写出G的结构简式: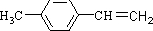 .
.
(2)填写表格:
 )的一条路线如下:
)的一条路线如下:已知-CHO可以在催化剂的条件下被氢气还原为-CH2OH

(1)写出G的结构简式:
 .
.(2)填写表格:
| 序号 | 所加试剂及反应条件 | 反应类型 |
| ② | 浓H2SO4,△ | 消去反应 |
| ③ | Br2的CCl4溶液 | 加成反应 |
| ④ | NaOH,C2H5OH,△ | 消去反应 |
10.在恒容密闭容器中,可逆反应H2(g)+I2(g)?2HI(g)达到平衡时的标志是( )
| A. | 1个I-I键断裂的同时,有2个H-I键断裂 | |
| B. | H2、I2、HI的浓度相等 | |
| C. | 混合气体的质量不再改变 | |
| D. | 混合气体密度恒定不变 |
17.下列化学反应的离子方程式正确的是( )
| A. | 铯与水反应:Cs+H2O═Cs++OH-+H2↑ | |
| B. | 实验室检验氯气:Cl2+2I-═I2+2Cl- | |
| C. | 实验室制氨气:NH4++OH-═H2O+NH3↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
7.等物质的量的PCl5(g)分别放入起始体积相同的恒压容器A和恒容容器B中,相同温度下反应:PCl5(g)?PCl3(g)+Cl2(g)达到平衡时,两容器中PCl5的分解率相比(用X表示)( )
| A. | XA>XB | B. | XA<XB | C. | XA=XB | D. | 无法确定 |
14.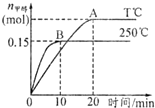 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).
根据右图,下列分析中正确的是( )
 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g)?CH3OH(g).根据右图,下列分析中正确的是( )
| A. | 250°C时,反应在前10 s 的平均速率v(H2)=0.015 mol/(L.min) | |
| B. | 平衡时CO的转化率:250°C>T0C | |
| C. | 反应达平衡后,其他条件不变,若减小容积体积,CO体积分数增大 | |
| D. | 该反应的正反应是放热反应 |
11.下列叙述正确的是( )
| A. | 48 g O3气体含有6.02×1023个O3分子 | |
| B. | 常温常压下,4.6g NO2气体含有1.81×1023个NO2分子 | |
| C. | 0.5mol/LCuCl2溶液中含有3.01×1023个Cu2+ | |
| D. | 标准状况下,33.6L 水含有9.03×1023个H2O分子 |