题目内容
3.对于可逆反应:C(s)+H2O (g)?CO(g)+H2(g)(正反应为吸热反应),达到平衡后.增大压强(反应在密闭容器中进行),平衡时混合气体的平均相对分子质量增大(填“增大”“减小”、“不变”、“不确定”).分析 反应前后是气体体积增大的反应,增大压强,平衡向气体体积减小的分析进行,结合气体平均摩尔质量=$\frac{气体总质量}{气体总物质的量}$分析.
解答 解:对于可逆反应:C(s)+H2O (g)?CO(g)+H2(g)(正反应为吸热反应),达到平衡后.增大压强平衡逆向进行,逆向是气体体积减小的反应,气体物质的量减小,气体质量减小,每生成18g水只生成12gC,气体总体积减少了二分之一,但质量为减少二分之一,平衡时混合气体的平均相对分子质量变化增大,
故答案为:增大.
点评 本题考查了影响化学平衡的因素分析判断,主要是气体摩尔质量的计算和变化分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
13.图1是Zn和Cu形成原电池,某实验兴趣小组做完实验后,在读书卡片(如图2)上写下了一些记录:在卡片上,描述合理的是( )


| A. | ①②③ | B. | ②③④ | C. | ④⑤⑥ | D. | ③④⑤ |
14.下列叙述正确的是( )
| A. | pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5 | |
| B. | 溶液中c(H+)越大,pH值也越大,溶液的酸性就越强 | |
| C. | 液氯、液氨、液态氯化氢都不能导电,所以它们都不是电解质 | |
| D. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
11.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LCHCl3中含有的氯原子数目为3NA | |
| B. | 7.8gNa2S和Na2O2的固体混合物中含有的阴离子数为0.1NA | |
| C. | 标准状态下,11.2LSO3气体分子数为0.5NA | |
| D. | 1molFeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA |
18.如表是元素周期表的一部分.(注意:以下各空请用化学术语答题,不能用字母代替)
(1)A~H八种元素中:
a.原子半径最小的元素对应的单质是F2,还原性最强的单质是K.
b.最高价氧化物对应的水化物酸性最强的酸的化学式是HClO4.
(2)C元素的离子结构示意图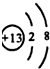 ,用电子式表示AD2的形成过程
,用电子式表示AD2的形成过程 .
.
(3)G元素的最高价氧化物的电子式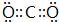 .
.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
a.原子半径最小的元素对应的单质是F2,还原性最强的单质是K.
b.最高价氧化物对应的水化物酸性最强的酸的化学式是HClO4.
(2)C元素的离子结构示意图
 ,用电子式表示AD2的形成过程
,用电子式表示AD2的形成过程 .
.(3)G元素的最高价氧化物的电子式
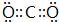 .
.
8.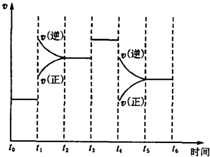 已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )
已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )
 已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )
已知反应N2(g)+3H2(g)?2NH3(g),△H=-92.2kJ•mol-1.在某段时间t0~t6中反应速率与反应时间的曲线如图所示,则氨的平衡浓度最高的一段时间是( )| A. | t2~t3 | B. | t0~t1 | C. | t4~t5 | D. | t6~t7 |
15.X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径X>Y,Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A. | 晶体 H2Y的分子之间为密集堆积 | |
| B. | XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | 由元素X与Z形成的化合物中只含共价键 |
12.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断正确的是( )
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3>YH3>ZH3 | ||
| C. | 元素的非金属强弱:X>Y>Z | D. | 电子层数:X>Y>Z |