19.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol.下列关于中和热的说法中正确的是( )
| A. | 在稀溶液中所有酸和碱反应的中和热数值都相等 | |
| B. | 在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等 | |
| C. | 在稀溶液中HCl和NaOH反应、HNO3和KOH反应的中和热相等 | |
| D. | 将浓硫酸滴入稍过量的氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和热 |
18.提高能源的利用率已成为国际能源研究的热点课题.下列相关措施使用不当的是( )
| A. | 使燃料充分燃烧 | B. | 加大能源开采力度 | ||
| C. | 加强能源利用的科技投入 | D. | 合理使用能源 |
17.某同学为了检验纤维素的水解产物是否为葡萄糖,他将纤维素与70%的硫酸共热后加入新制Cu(OH)2悬浊液并加热煮沸,无红色沉淀生成,以下解释正确的是( )
| A. | 纤维素水解产物中无葡萄糖 | |
| B. | 使用的硫酸过浓,只发生了脱水反应 | |
| C. | 由于水解后混合液中含有H2SO4,所以见不到红色沉淀 | |
| D. | 加热时间不够长,所以见不到红色沉淀 |
16. 已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
(1)请写出括号内物质的化学式CO2;
(2)在其它相同条件下,小组同学通过实验测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:
表中①、②处的数据分别是25、5.0;
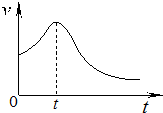
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时
间内,速率变快可能是该反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成物作催化剂的影响.
(4)若用实验证明你的猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是MnSO4.
 已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.(1)请写出括号内物质的化学式CO2;
(2)在其它相同条件下,小组同学通过实验测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3 mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6 mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时
间内,速率变快可能是该反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成物作催化剂的影响.
(4)若用实验证明你的猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是MnSO4.
15.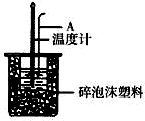 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如右图所示,仪器A的名称是环形玻璃搅拌棒;大小烧瓶间填满泡沫塑料的作用减少实验过程中的热量损失.
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3kJ/(g•℃).
为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ/mol;(结果保留一位小数)
(4)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.把NaOH溶液迅速倒入盛有稀硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的.
 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如右图所示,仪器A的名称是环形玻璃搅拌棒;大小烧瓶间填满泡沫塑料的作用减少实验过程中的热量损失.
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3kJ/(g•℃).
为了计算中和热,某学生实验记录数据如下:
| 实验序号 | 起始温度t1℃ | 终止温度t1℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(4)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.把NaOH溶液迅速倒入盛有稀硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的.
14.下列说法正确的是( )
| A. | 升高温度,正反应速率增大,逆反应速率减小 | |
| B. | 在温度和体积一定的情况下,通入氦气化学反应速率不变 | |
| C. | 增大压强可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 使用催化剂,可以改变反应的△H |
11.关于溶液的酸碱性说法正确的是( )
0 171352 171360 171366 171370 171376 171378 171382 171388 171390 171396 171402 171406 171408 171412 171418 171420 171426 171430 171432 171436 171438 171442 171444 171446 171447 171448 171450 171451 171452 171454 171456 171460 171462 171466 171468 171472 171478 171480 171486 171490 171492 171496 171502 171508 171510 171516 171520 171522 171528 171532 171538 171546 203614
| A. | c(OH-)>10-7 mol•L-1的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(H+)=c(OH-)的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
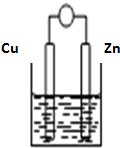 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: