题目内容
19.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol.下列关于中和热的说法中正确的是( )| A. | 在稀溶液中所有酸和碱反应的中和热数值都相等 | |
| B. | 在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等 | |
| C. | 在稀溶液中HCl和NaOH反应、HNO3和KOH反应的中和热相等 | |
| D. | 将浓硫酸滴入稍过量的氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和热 |
分析 A、弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热;
B、一元酸和二元酸与一元碱和二元碱反应放出的热量不等;
C、HCl和NaOH反应、HNO3和KOH反应都可以用H+(aq)+OH-(aq)=H2O(l)表示;
D、浓硫酸稀释要放热.
解答 解:A、弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,生成1mol液态水放出的热量小于57.3kJ,故A错误,
B、一元酸和二元酸与一元碱和二元碱反应放出的热量不等,故B错误;
C、HCl和NaOH反应、HNO3和KOH反应都可以用H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则稀的强酸与稀的强碱反应生成1mol液态水时,放出热量57.3kJ,中和热相等,故C正确;
D、浓硫酸稀释要放热,所以放出热量大于57.3kJ,故D错误.
故选:C.
点评 考查学生对中和热的理解,难度不大,主要把握离子反应表示的含义与反应热的数值的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的 关系如下表:
①写出该反应的平衡常数表达式.K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$.
②试判断K1>K2(填写“>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)化合物N2 H4 做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.
某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图2所示.
①该燃料电池的负极反应式为N2H4+4OH--4e-=N2↑+4H2O;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图中曲线 I、II所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L
③在t2时所得溶液的pH为1.(假设溶液体积不变)
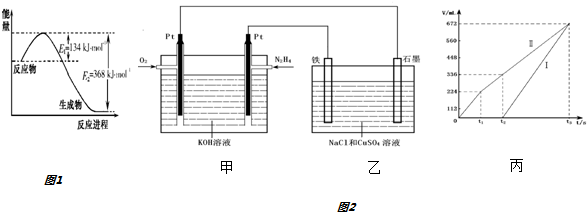
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的 关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)化合物N2 H4 做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.
某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图2所示.
①该燃料电池的负极反应式为N2H4+4OH--4e-=N2↑+4H2O;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图中曲线 I、II所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L
③在t2时所得溶液的pH为1.(假设溶液体积不变)

7.关于油脂在人体中的生理功能的理解错误的是( )
| A. | 油脂水解后的产物经氧化为人体提供能量 | |
| B. | 多摄入动物脂肪对人体有害 | |
| C. | 油脂能保持体温,保护内脏器官 | |
| D. | 油脂能促进VB、VC的吸收 |
14.下列说法正确的是( )
| A. | 升高温度,正反应速率增大,逆反应速率减小 | |
| B. | 在温度和体积一定的情况下,通入氦气化学反应速率不变 | |
| C. | 增大压强可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 使用催化剂,可以改变反应的△H |
4.下列物质的电子式书写正确的是( )
| A. |  | B. | 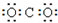 | C. |  | D. | 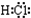 |
8.下列说法正确的是( )
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 在一个确定的化学反应体系中,反应物的总能量总是高于生成物的总能量 |