题目内容
18.提高能源的利用率已成为国际能源研究的热点课题.下列相关措施使用不当的是( )| A. | 使燃料充分燃烧 | B. | 加大能源开采力度 | ||
| C. | 加强能源利用的科技投入 | D. | 合理使用能源 |
分析 A.使燃料充分燃烧能提高燃烧的效率;
B.常规能源应该减少开采,节约利用;
C.加强能源利用的科技投入能提高能源的利用率;
D.合理使用能源,减少能源浪费.
解答 解:A.使燃料充分燃烧能提高燃烧的效率,提高能源的利用率,故A正确;
B.常规能源应该减少开采,节约利用,加大能源开采力度不能提高能源利用率,故B错误;
C.加强能源利用的科技投入能提高能源的利用率,故C正确;
D.合理使用能源,减少能源浪费,能提高能源的利用率,故D正确.
故选B.
点评 本题考查常见的能量转化形式,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.在潜水艇中和防毒面具中也用来消除CO2的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2O | D. | Na2O2 |
6.关于氨基酸的叙述错误的是( )
| A. | 人体内氨基酸的分解代谢最终产物是水、二氧化碳和尿素 | |
| B. | 构成蛋白质的氨基酸分子的结构通式可以表示为: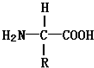 | |
| C. | 氨基酸只能和碱反应不能和酸反应 | |
| D. | 两个氨基酸通过脱水缩合形成二肽 |
3.人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害.人体内生成的下列酸属于无机物的是( )
| A. | 乳酸(C3H6O3) | B. | 磷酸(H3PO4) | C. | 丙酮酸(C3H4O3) | D. | 乙酰乙酸(C4H6O3) |
7.下列各组物质中,肯定全都属于纯净物的是( )
| A. | 液氯和氯水 | B. | 酒精溶液和乙醇 | ||
| C. | 七水合硫酸亚铁和硫酸亚铁 | D. | 干冰和混有冰的干冰 |
9. 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
已知室温下:Ka(CH3COOH)=1.7×10-5 mol•L-1;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)常温下,物质的量浓度相同的下列四种溶液:a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液.其PH由大到小的顺序是:a>b>c>d>e(填序号).
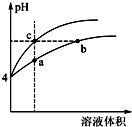
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列各量一定变小的是ad.
a.c(H+) b.c(OH-) c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.12mol/L.
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=10-12mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=11.
 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.已知室温下:Ka(CH3COOH)=1.7×10-5 mol•L-1;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)常温下,物质的量浓度相同的下列四种溶液:a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液.其PH由大到小的顺序是:a>b>c>d>e(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列各量一定变小的是ad.
a.c(H+) b.c(OH-) c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度(mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol/L.
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=10-12mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=11.
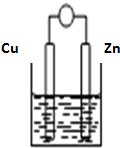 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: