题目内容
16. 已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.
已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2.(1)请写出括号内物质的化学式CO2;
(2)在其它相同条件下,小组同学通过实验测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3 mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6 mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
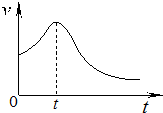
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时
间内,速率变快可能是该反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成物作催化剂的影响.
(4)若用实验证明你的猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是MnSO4.
分析 (1)依据原子个数守恒判断产物;
(2)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同;
(3)影响化学反应速率的因素主要有温度、浓度、压强和催化剂,据此解答;
(4)要想验证锰离子的催化作用,再加入硫酸锰即可.
解答 解:(1)依据原子个数守恒,2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10(CO2),
故答案为:CO2;
(2)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同,则②应为25℃,由①③数据可知溶液体积为15mL,则①为5.0mL,故答案为:25;5.O;
(3)影响化学反应速率的因素主要有温度、浓度、压强和催化剂,反应为放热反应,温度升高,且生成的锰离子对反应可能起到催化作用,都可加快反应速率,随着反应的进行,浓度逐渐降低,此时反应速率又减小,
故答案为:生成物作催化剂;
(4)要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可;
故答案为:MnSO4.
点评 本题考查了探究影响化学反应速率的因素,侧重于学生的分析能力和实验能力的考查,注意做对比实验时只能改变一个条件,其它条件必须相同,否则无法得出正确结论,题目难度中等.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
6.下列关于钠的说法正确的是( )
| A. | 钠是活泼的非金属 | B. | 钠与水反应放出氧气 | ||
| C. | 钠与水反应放出氢气 | D. | 钠不与盐酸反应 |
7.燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误的是( )
| A. | 燃料电池的负极反应物是氢气、甲烷、乙醇等物质 | |
| B. | 氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用 | |
| C. | H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-═2H2O | |
| D. | 乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-═2CO2↑+3H2O |
4.一次性筷子的大量使用加速了对森林的破坏.森林是二氧化碳的转换器,是降雨的发生器,是洪涝的控制器,是生物多样性的保护区,此功能绝不是生产一次性筷子所得的效益能代替的.二氧化碳的大量排放可能引起的环境问题( )
| A. | 臭氧层空洞 | B. | 光化学烟雾 | C. | 酸雨 | D. | 温室效应 |
11.关于溶液的酸碱性说法正确的是( )
| A. | c(OH-)>10-7 mol•L-1的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(H+)=c(OH-)的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
1.下表是某食品包装袋上的说明.
(1)其中属于营养强化剂的有(填一种,下同)维生素C,属于防腐剂的有山梨酸钾.
(2)下列关于食品添加剂的说法中,正确的是c.
a.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
b.为了使婴儿食品的色泽诱人,可以加少量着色剂
c.为了预防地方性甲状腺肿,可以在食盐中加适量碘酸钾
(3)医学科学家们研究发现,食物中除糖类、脂肪、蛋白质外,还有一类物质与人体健康有着密切关系,它们就是维生素.下列维生素中,属于脂溶性维生素的是a(填序号,下同),可用于防治坏血病的是d.
a.维生素A b.维生素B1 c.维生素B2 d.维生素C.
| 品 名 | 浓缩菠萝汁 |
| 配 料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
(2)下列关于食品添加剂的说法中,正确的是c.
a.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
b.为了使婴儿食品的色泽诱人,可以加少量着色剂
c.为了预防地方性甲状腺肿,可以在食盐中加适量碘酸钾
(3)医学科学家们研究发现,食物中除糖类、脂肪、蛋白质外,还有一类物质与人体健康有着密切关系,它们就是维生素.下列维生素中,属于脂溶性维生素的是a(填序号,下同),可用于防治坏血病的是d.
a.维生素A b.维生素B1 c.维生素B2 d.维生素C.
8.在pH=1的溶液中,可以大量共存的离子组是( )
| A. | Na+、K+、S2-、Cl- | B. | K+、Na+、SO42-、NO3- | ||
| C. | K+、Na+、SiO32-、NO3- | D. | Ba2+、Mg2+、SO42-、Cl- |
5.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器内压强不随时间而变化 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 容器中各组分的体积分数不随时间变化 |