3.科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
Ⅰ四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2悬浊液制备Cu2O;
(c)电解法制备Cu2O.原理如右图所示反应为:2Cu+H2O=Cu2O+H2↑,则铜作为阳极;
(d)最新实验研究加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2和水蒸气.该制法的化学方程式为4Cu(OH)2+N2H4 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O.
Ⅱ用制得的Cu2O进行催化分解水的实验Cu2O光照
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:
2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1
T1温度下不同时段产生O2的量见下表:
前20min的反应速率 v(H2O)=5.0×10-5 mol.L-1.min -1;该该温度下,反应的平衡常数的表达式K=$\frac{{c}^{2}({H}_{2})•c({O}_{2})}{{c}^{2}({H}_{2}O)}$;若T2温度下K=0.4,T1>T2(填>、<、=)
(2)用以上四种方法制得的Cu2O在某相同条件下分别对四份 相同质量的水催化分解,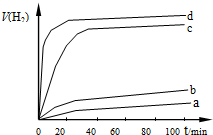 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
A.d方法制得的Cu2O能使水剧烈分解并放出热量
B.d方法制得的Cu2O颗粒最小,表面活性大,所以催化效果明显.
C. c、d 产生的氢气总体积不同可能和水的蒸发有关
D. d方法制得的Cu2O作催化剂时,水的平衡转化率最高.
Ⅰ四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2悬浊液制备Cu2O;
(c)电解法制备Cu2O.原理如右图所示反应为:2Cu+H2O=Cu2O+H2↑,则铜作为阳极;
(d)最新实验研究加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2和水蒸气.该制法的化学方程式为4Cu(OH)2+N2H4 $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2+6H2O.
Ⅱ用制得的Cu2O进行催化分解水的实验Cu2O光照
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入10.0mol水蒸气,发生反应:
2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1
T1温度下不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |
(2)用以上四种方法制得的Cu2O在某相同条件下分别对四份 相同质量的水催化分解,
 产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).
产生的氢气经干燥装置并用针筒收集;V(H2)随时间t变化如右图所示.下列叙述正确的是BC(双选题).A.d方法制得的Cu2O能使水剧烈分解并放出热量
B.d方法制得的Cu2O颗粒最小,表面活性大,所以催化效果明显.
C. c、d 产生的氢气总体积不同可能和水的蒸发有关
D. d方法制得的Cu2O作催化剂时,水的平衡转化率最高.
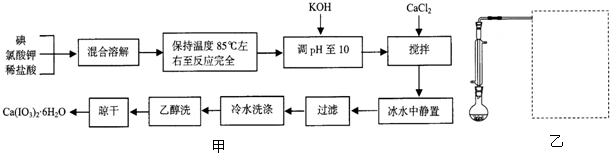
2.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的某工艺流程示意图.
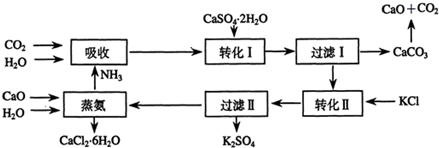
(1)在这个工艺中,有很多粒子都具有相同的电子数.
写出该工艺中具有相同电子数的四种粒子的化学式:NH3、H2O、NH4+、OH-、H3O+五种的任意四种.
(2)1919年由Langmuir提出了等电子体.原子数相同、电子数相同的粒子,互称为等电子体.A、B、C、D、E、F 是原子序数依次增大的6种位于元素周期表前20号的元素.B、C、D、E位于同周期.C是构成空气的主要元素.F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体.B22-与C2是等电子体,D22-与E2是等电子体.F原子的N层电子数与K层电子数相同.
①比较C、D、E对应的简单阴离子的半径(用离子符号表示)N3->O2->F-(由大到小);
②写出能证明D和E非金属性强弱的一个化学方程式2F2+2H2O=4HF+O2.
③由上述6种元素中的4种构成的离子化合物是(写出两种)NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca其中两种,其中所含的化学键类型有离子键、共价键.
(3)①过滤Ⅱ所得滤液中大量含有的阳离子有哪些?请分别检验.(可不填满下表)
②写出此工艺的总反应方程式CaSO4•2H2O+2KCl+4H2O=K2SO4+CaCl2•6H2O.
0 171311 171319 171325 171329 171335 171337 171341 171347 171349 171355 171361 171365 171367 171371 171377 171379 171385 171389 171391 171395 171397 171401 171403 171405 171406 171407 171409 171410 171411 171413 171415 171419 171421 171425 171427 171431 171437 171439 171445 171449 171451 171455 171461 171467 171469 171475 171479 171481 171487 171491 171497 171505 203614

(1)在这个工艺中,有很多粒子都具有相同的电子数.
写出该工艺中具有相同电子数的四种粒子的化学式:NH3、H2O、NH4+、OH-、H3O+五种的任意四种.
(2)1919年由Langmuir提出了等电子体.原子数相同、电子数相同的粒子,互称为等电子体.A、B、C、D、E、F 是原子序数依次增大的6种位于元素周期表前20号的元素.B、C、D、E位于同周期.C是构成空气的主要元素.F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体.B22-与C2是等电子体,D22-与E2是等电子体.F原子的N层电子数与K层电子数相同.
①比较C、D、E对应的简单阴离子的半径(用离子符号表示)N3->O2->F-(由大到小);
②写出能证明D和E非金属性强弱的一个化学方程式2F2+2H2O=4HF+O2.
③由上述6种元素中的4种构成的离子化合物是(写出两种)NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca其中两种,其中所含的化学键类型有离子键、共价键.
(3)①过滤Ⅱ所得滤液中大量含有的阳离子有哪些?请分别检验.(可不填满下表)
| 所含离子 | 检验方法 |
| K+ | 取少量滤液于试管中,通过焰色反应,火焰呈紫色(透过蓝色钴玻璃) |
| NH4+ | 取少量滤液于试管中,并向其中加入NaOH微热,有刺激性气味产生(该气体可使湿润红色石蕊试纸变蓝) |
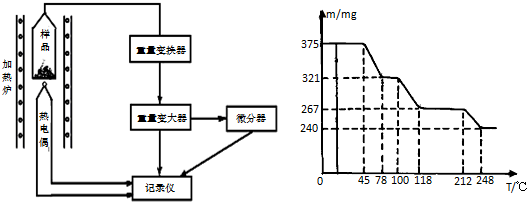
 .
.
 2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( ) 2NH3.下列关于该反应的说法正确的是( )
2NH3.下列关于该反应的说法正确的是( ) 2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( ) CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( ) 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是( )