题目内容
深海中存在可燃冰(CH4•nH2O固体).已知:CH4•nH2O(s)  CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
A.低温高压 B.高温低压 C.低温低压 D.高温高压
练习册系列答案
相关题目
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L﹣1•mim﹣1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
2.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的某工艺流程示意图.
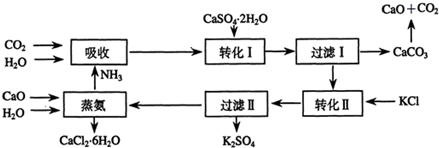
(1)在这个工艺中,有很多粒子都具有相同的电子数.
写出该工艺中具有相同电子数的四种粒子的化学式:NH3、H2O、NH4+、OH-、H3O+五种的任意四种.
(2)1919年由Langmuir提出了等电子体.原子数相同、电子数相同的粒子,互称为等电子体.A、B、C、D、E、F 是原子序数依次增大的6种位于元素周期表前20号的元素.B、C、D、E位于同周期.C是构成空气的主要元素.F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体.B22-与C2是等电子体,D22-与E2是等电子体.F原子的N层电子数与K层电子数相同.
①比较C、D、E对应的简单阴离子的半径(用离子符号表示)N3->O2->F-(由大到小);
②写出能证明D和E非金属性强弱的一个化学方程式2F2+2H2O=4HF+O2.
③由上述6种元素中的4种构成的离子化合物是(写出两种)NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca其中两种,其中所含的化学键类型有离子键、共价键.
(3)①过滤Ⅱ所得滤液中大量含有的阳离子有哪些?请分别检验.(可不填满下表)
②写出此工艺的总反应方程式CaSO4•2H2O+2KCl+4H2O=K2SO4+CaCl2•6H2O.

(1)在这个工艺中,有很多粒子都具有相同的电子数.
写出该工艺中具有相同电子数的四种粒子的化学式:NH3、H2O、NH4+、OH-、H3O+五种的任意四种.
(2)1919年由Langmuir提出了等电子体.原子数相同、电子数相同的粒子,互称为等电子体.A、B、C、D、E、F 是原子序数依次增大的6种位于元素周期表前20号的元素.B、C、D、E位于同周期.C是构成空气的主要元素.F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体.B22-与C2是等电子体,D22-与E2是等电子体.F原子的N层电子数与K层电子数相同.
①比较C、D、E对应的简单阴离子的半径(用离子符号表示)N3->O2->F-(由大到小);
②写出能证明D和E非金属性强弱的一个化学方程式2F2+2H2O=4HF+O2.
③由上述6种元素中的4种构成的离子化合物是(写出两种)NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca其中两种,其中所含的化学键类型有离子键、共价键.
(3)①过滤Ⅱ所得滤液中大量含有的阳离子有哪些?请分别检验.(可不填满下表)
| 所含离子 | 检验方法 |
| K+ | 取少量滤液于试管中,通过焰色反应,火焰呈紫色(透过蓝色钴玻璃) |
| NH4+ | 取少量滤液于试管中,并向其中加入NaOH微热,有刺激性气味产生(该气体可使湿润红色石蕊试纸变蓝) |
9.下列物质在一定条件下不能发生水解反应的是( )
| A. | 蔗糖 | B. | 植物油 | C. | 葡萄糖 | D. | 淀粉 |
6. 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D (从下列选出)
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol( 取小数点后一位).
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D (从下列选出)
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
7.已知:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
| A. | I2>Cl2>FeCl3 | B. | FeCl3>Cl2>I2 | C. | Cl2>I2>FeCl3 | D. | Cl2>FeCl3>I2 |