9.下列做法不符合低碳发展原则的是( )
| A. | 发展氢能和太阳能 | B. | 限制塑料制品的使用 | ||
| C. | 提高原子利用率,发展绿色化学 | D. | 尽量用纯液态有机物代替水作溶剂 |
8.已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
(1)元素F在元素周期表中的位置是第三周期ⅥA族.这七种元素中,不属于主族元素的元素的名称是氖.
(2)在E、F、G三种元素中,原子半径最小的是Cl(填元素符号).
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为共价键,分子的空间结构为正四面体.A与氧元素可形成化合物AO2,该化合物分子的电子式为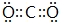 .
.
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈碱(填“酸”、“碱”或“中”)性,原因为NH3•H2O NH4++OH-(用方程式表示)
NH4++OH-(用方程式表示)
| 元素 | 原子结构特征或有关物质的性质 |
| A | 原子的最外层电子数是其内层电子数的2倍 |
| B | 其单质是空气中含量最多的物质 |
| C | 原子的最外层电子数是其电子层数的4倍 |
| D | 位于第ⅡA族,其原子半径比E的大 |
| E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F | 原子序数16,其单质在通常状况下为固体 |
| G | 原子的最外层电子数比其次外层电子数少1个 |
(2)在E、F、G三种元素中,原子半径最小的是Cl(填元素符号).
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为共价键,分子的空间结构为正四面体.A与氧元素可形成化合物AO2,该化合物分子的电子式为
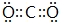 .
.(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈碱(填“酸”、“碱”或“中”)性,原因为NH3•H2O
 NH4++OH-(用方程式表示)
NH4++OH-(用方程式表示)
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g CO含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的H2O分子数为NA | |
| C. | 1mol Fe与足量盐酸反应失去的电子数为2NA | |
| D. | 0.1L 2mol/L NaCl溶液中含有Na+个数为2NA |
5.M、N、X、Y四种物质有如下转化关系,M$→_{反应①}^{X}$N$→_{反应②}^{X}$Y(反应条件和其他产物已省略),下列选项不可能的是( )
| A. | M:Na X:O2 | B. | M:IINO3 X:Fe | C. | M:NH3 X:O2 | D. | M:Al X:NaOH |
3.已经反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
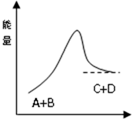

| A. | 铝与稀盐酸的反应符合该图示 | B. | 该反应为吸热反应 | ||
| C. | A的能量一定低于C的能量 | D. | 该反应只有在加热条件下才能进行 |
2.下列实验能达到目的是( )
| A. | 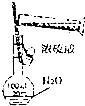 稀释浓硫酸 | B. | 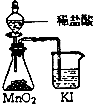 比较MnO2、CI2、I2的氧化性 | ||
| C. | 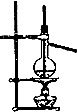 分离乙醇和水 | D. | 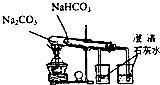 比较Na2CO3、NaHCO3的热稳定性 |
1. 外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )
外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )
 外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )
外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=3+D中产物D的浓度随时间变化的关系如图.则下列有关说法正确的是( )| A. | p=8.8时,升高温度,反应速率不变 | |
| B. | 保持外界条件不变,反应一段时间后,pH越小,D的浓度越大 | |
| C. | 为了实验取样,可以采用调节pH的方法迅速停止反应 | |
| D. | 减小外界压强,反应速率一定减小 |
20.阿托酸是一种常用的医药中间体,其结构如图所示: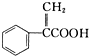 .下列有关说法正确的是( )
.下列有关说法正确的是( )
0 171205 171213 171219 171223 171229 171231 171235 171241 171243 171249 171255 171259 171261 171265 171271 171273 171279 171283 171285 171289 171291 171295 171297 171299 171300 171301 171303 171304 171305 171307 171309 171313 171315 171319 171321 171325 171331 171333 171339 171343 171345 171349 171355 171361 171363 171369 171373 171375 171381 171385 171391 171399 203614
 .下列有关说法正确的是( )
.下列有关说法正确的是( )| A. | 阿托酸的分子式为C9 H8O2 | |
| B. | lmol阿托酸最多能和4mol Br2发生加成反应 | |
| C. | 阿托酸分子中所有碳原子一定在同一平面 | |
| D. | 阿托酸能发生取代、加成、水解等反应 |


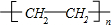 .
.