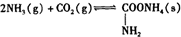9.可以鉴别CH4、CO、H2的方法是( )
| A. | 点燃--通入澄清石灰水--加溴水 | |
| B. | 点燃--罩上干燥烧杯--通入澄清石灰水 | |
| C. | 点燃--通入澄清石灰水 | |
| D. | 点燃--通入酸性KMnO4溶液 |
6.下列物质中既有离子键又有共价键的是( )
| A. | CaCl2 | B. | H2O2 | C. | K2SO4 | D. | H2S |
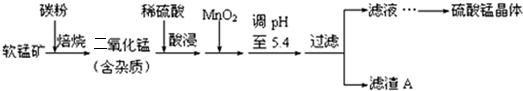
4.工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为MnO+2H+=Mn2++H2O.酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是确保铁元素在后续操作中完全转化为氢氧化物沉淀而除去.
(2)滤渣A的成分除MnO2外,还有Fe(OH)3和Al(OH)3.
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2.工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,当阴极产生4.48L(标况)气体时,MnO2的理论产量为17.4g.
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS(填写化学式).

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(2)滤渣A的成分除MnO2外,还有Fe(OH)3和Al(OH)3.
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2.工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,当阴极产生4.48L(标况)气体时,MnO2的理论产量为17.4g.
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS(填写化学式).
2.如表是四种盐在不同温度下的溶解度(g/100g水):
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图所示:
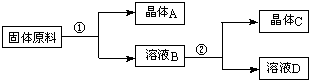
(1)在①和②的实验过程中,需要控制的关键的实验条件是控制温度,在上述晶体中,C(填“A”或“C”)应为硝酸钾晶体.
(2)在①的实验过程中,需要进行的操作依次是加水溶解、蒸发浓缩、趁热过滤.
(3)粗产品中可能含有杂质离子Na+、Cl-,检验其中一种离子的方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-.
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc(填编号).
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为15.58g.
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
某同学设计用物质的量之比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是控制温度,在上述晶体中,C(填“A”或“C”)应为硝酸钾晶体.
(2)在①的实验过程中,需要进行的操作依次是加水溶解、蒸发浓缩、趁热过滤.
(3)粗产品中可能含有杂质离子Na+、Cl-,检验其中一种离子的方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-.
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc(填编号).
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为15.58g.
7.下列说法中不正确的是( )
0 171179 171187 171193 171197 171203 171205 171209 171215 171217 171223 171229 171233 171235 171239 171245 171247 171253 171257 171259 171263 171265 171269 171271 171273 171274 171275 171277 171278 171279 171281 171283 171287 171289 171293 171295 171299 171305 171307 171313 171317 171319 171323 171329 171335 171337 171343 171347 171349 171355 171359 171365 171373 203614
| A. | 电负性的大小顺序为Cl>S>P | |
| B. | 由于NO3-和SO3互为等电子体,所以可以推断NO3-的空间构型为平面三角形 | |
| C. | 根据晶格能的大小可以判断MgCl2的熔点比CaCl2高 | |
| D. | 液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大 |

 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
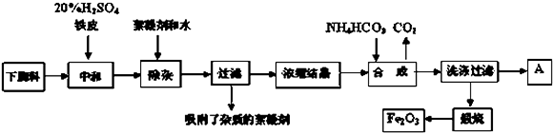
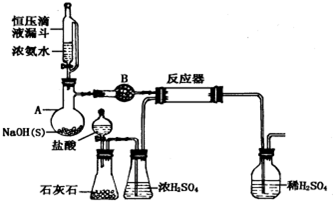 氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:
氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下: