题目内容
6.下列物质中既有离子键又有共价键的是( )| A. | CaCl2 | B. | H2O2 | C. | K2SO4 | D. | H2S |
分析 离子键:阴阳离子间的静电作用;共价键:原子间通过共用电子对所形成的强烈的相互作用.
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键.
解答 解:A.氯化钙中只含离子键,故A错误;
B.过氧化氢中只含共价键,故B错误;
C.K2SO4中钾离子和硫酸根离子之间存在离子键,氧原子和硫原子之间存在共价键,故C正确;
D.硫化氢中只含共价键,故D错误;
故选C.
点评 本题考查了化学键的判断,注意离子键和共价键的区别,难度不大,一般通过成键元素的类型判断较简单.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
3.除杂提纯下列各物质,请写出所选化学试剂的化学式及反应的离子方程式.
| 混合物成分 | 化学试剂 | 离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 | ||
| FeCl2中含有少量FeCl3杂质 | ||
| NaNO3中含有少量NaCl杂质 |
4.CsICI2常用于化学上的分子筛技术,它既有氧化性又有还原性,下列有关的说法正确的是( )
| A. | CsICI2有氧化性,是因为Cs显+3价 | |
| B. | CsICI2有还原性,是因为含有较强还原性的I- | |
| C. | 酸性高锰酸钾溶液中滴加CsICI2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中滴加HNO3,可生成Cl2 |
1.下列说法正确的是( )
| A. | 可用如图所示装置作为实验室制取乙烯的发生装置 | |
| B. | 乙烯与酒精蒸汽按任意物质的量比混合,取VL该气体完全燃烧,相同条件消耗O2体积为3VL | |
| C. | 乙烯、乙醇都能使酸性高锰酸钾溶液褪色,符合通式CnH2n和CnH2n+2O的物质也都能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯在光照条件和 FeBr3作用下都能与Br2反应,反应产物相同 |
11.下列各组粒子中,所含化学键类型有差异的是( )
| A. | CCl4 和CH2Cl2 | B. | H3O+ 和NH4+ | C. | CaO2 和 CaF2 | D. | Ba(0H)2 和NaOH |
18.具有下列电子层结构的原子,其相应元素一定属于同一主族的是( )
| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 | |
| D. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 |
15. 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
 如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )
如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为( )| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是AgNO3稀溶液 | D. | A是Ag,B是Fe,C是AgNO3稀溶液 |
16.反应3Fe(s)+4H2O(g)$\stackrel{高温}{?}$Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使化学反应速率加快的是( )
| A. | 增加Fe的量 | |
| B. | 将容器的容积缩小一半 | |
| C. | 保持容积不变,充入N2使体系压强增大 | |
| D. | 压强不变,充入N2使容器容积增大 |
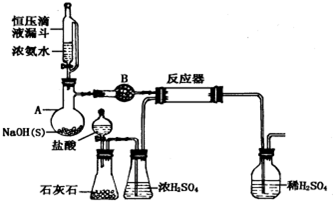 氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:
氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下: