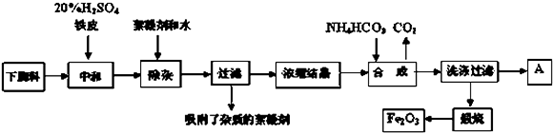
题目内容
8.某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石.图1所示是利用该镁矿石制备七水硫酸镁(MgSO4•7H2O)的工艺流程,图2是CaSO4和MgSO4的溶解度曲线.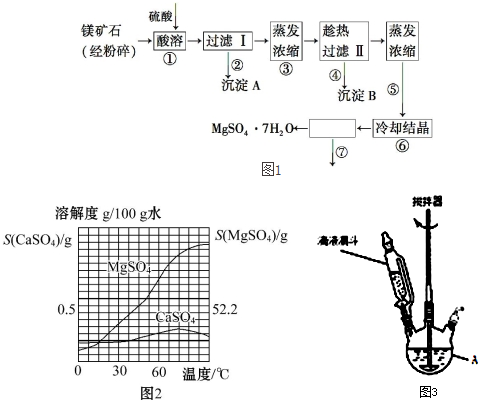
根据以上信息回答下列问题:
(1)步骤①可在图3装置中进行,仪器A的名称是三颈烧瓶,硫酸要分批缓慢加入的原因是防止硫酸加入过快导致反应中产生大量泡沫使物料从反应器溢出,矿石要粉碎和反应过程中不断搅拌的主要目的是防止反应生成的硫酸钙包裹在镁矿石表面导致反应难以进行,碳酸镁与硫酸反应的化学方程式MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)沉淀A的成分是SiO2和少量的CaSO4或CaSO4•2H2O,
(3)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和漏斗.步骤④趁热过滤的作用是防止MgSO4•7H2O析出.
(4)步骤⑦的操作名称是过滤、洗涤、干燥.过滤操作时需将步骤⑥中冷却结晶后的溶液和晶体转移到漏斗中,最后器壁上往往还沾有少量晶体,需选用一种液体将器壁上的晶体淋洗并倾入漏斗中,下列液体最合适的是D
A.冰水 B.滤液 C.稀硫酸 D.无水乙醇
(5)步骤⑦中洗涤晶体时,先冰水洗,后用酒精洗,用冰水洗的目的:①除去晶体表面的硫酸等杂质,②降低洗涤过程中MgSO4•7H2O的损耗,用酒精洗的目的是除去晶体表面的水
(6)步骤⑦不宜采用加热干燥的方法,可能的原因是加热易使MgSO4•7H2O失去结晶水.
(7)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算.步骤③需要在干燥器中进行,理由是防止吸水;步骤⑤的目的是检验晶体中的结晶水是否已全部失去.
分析 镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石,加入硫酸后二氧化硅不反应,而碳酸镁、碳酸钙与硫酸反应生成硫酸钙、硫酸镁,硫酸钙为微溶物,则沉淀A中含有二氧化硅和CaSO4或CaSO4•2H2O;滤液中含有硫酸镁、硫酸和少量硫酸钙,根据温度对硫酸镁、硫酸钙的影响可通过蒸发浓缩、趁热过滤的方法出去硫酸钙,从而得到硫酸镁溶液;然后对过滤Ⅱ所得滤液进行蒸发浓缩、冷却结晶得到硫酸镁晶体,再通过⑦过滤、洗涤、干燥获得七水硫酸镁(MgSO4•7H2O),
(1)根据A的构造写出其名称;该反应中有气体生成,容易导致反应物溢出;根据硫酸钙为微溶物,易包裹在碳酸镁外边阻止了反应的进行分析;碳酸镁与硫酸反应生成硫酸镁、二氧化碳气体和水,据此写出反应的化学方程式;
(2)根据分析判断沉淀A的组成;
(3)根据过滤操作的方法判断使用的玻璃仪器;温度较高时,MgSO4在溶液中溶解度较大;
(4)获得的硫酸镁中混有少量稀硫酸,需要通过洗涤、干燥除去;MgSO4难溶于乙醇,用乙醇洗涤可以减少MgSO4的损失;
(5)温度低可以降低硫酸镁的损失,且能够除去硫酸;硫酸镁不容易乙醇,除去水分可用乙醇;
(6)晶体受热易分解失去结晶水;
(7)防止晶体吸收空气中的水分;重复步骤②~④至恒重,保证结晶水完全失去.
解答 解:镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石,加入硫酸后二氧化硅不反应,而碳酸镁、碳酸钙与硫酸反应生成硫酸钙、硫酸镁,硫酸钙为微溶物,则沉淀A中含有二氧化硅和硫酸钙;滤液中含有硫酸镁、硫酸和少量硫酸钙,根据温度对硫酸镁、硫酸钙的影响可通过蒸发浓缩、趁热过滤的方法出去硫酸钙,从而得到硫酸镁溶液;然后对过滤Ⅱ所得滤液进行蒸发浓缩、冷却结晶得到硫酸镁晶体,再通过⑦过滤、洗涤、干燥获得七水硫酸镁(MgSO4•7H2O),
(1)图3中A的名称为三颈烧瓶;硫酸与碳酸镁、碳酸钙的反应中有二氧化碳气体生成,若加入硫酸的量过快,则会导致反应中产生大量泡沫使物料从反应器溢出,所以加入分批缓慢加入硫酸的目的是防止硫酸加入过快导致反应中产生大量泡沫使物料从反应器溢出;
由于反应生成的硫酸钙包裹在镁矿石表面会导致反应难以进行,所以矿石要粉碎且反应过程中不断搅拌;
碳酸镁与硫酸反应的化学方程式为:MgCO3+H2SO4═MgSO4+H2O+CO2↑,
故答案为:三颈烧瓶;防止硫酸加入过快导致反应中产生大量泡沫使物料从反应器溢出;防止反应生成的硫酸钙包裹在镁矿石表面导致反应难以进行;MgCO3+H2SO4═MgSO4+H2O+CO2↑;
(2)硫酸钙微溶,所以沉淀A为CaSO4或CaSO4•2H2O,
故答案为:CaSO4或CaSO4•2H2O;
(3)根据过滤操作的方法可知,实验室过滤时需要用到的玻璃仪器是:玻璃棒、烧杯和漏斗;
温度较高时,MgSO4在溶液中溶解度较大,所以趁热过滤可以防止MgSO4从溶液中以晶体的形式析出,
故答案为:漏斗;防止MgSO4•7H2O晶体析出;
(4)获得较纯的硫酸镁晶体,需要通过过滤、洗涤、干燥的操作方法完成;
MgSO4难溶于乙醇,用乙醇冲洗可以减少MgSO4的损失,而选用冰水、滤液、稀硫酸均能使硫酸镁因为溶解而损失,
故答案为:洗涤、干燥;D;
(5)步骤⑦中洗涤晶体时,先冰水洗,后用酒精洗,用冰水洗的目的:①除去晶体表面的硫酸等杂质,②温度低溶解度小,从而降低洗涤过程中MgSO4•7H2O的损耗;获得的硫酸镁晶体表明中含有多余的水分,硫酸镁不溶于乙醇,故可用酒精洗洗涤,
故答案为:降低洗涤过程中MgSO4•7H2O的损耗;除去晶体表面的水;
(6)MgSO4•7H2O受热易分解失去结晶水转化为MgSO4,使得到的硫酸镁晶体的质量减小,所以不能采用直接加热法干燥;
故答案为:加热易使MgSO4•7H2O失去结晶水;
(7)晶体易吸水,为防止吸水步骤③需要在干燥器中进行;
步骤⑤重复步骤②~④至恒重,其目的是保证结晶水完全失去,减小测定误差,
故答案为:防止吸水;检验晶体中的结晶水是否已全部失去.
点评 本题考查了物质的制备、分离提纯实验方案的设计,题目难度较大,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,试题侧重分析与实验能力、以及计算能力的考查.

 阅读快车系列答案
阅读快车系列答案| A. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 漂白粉溶液吸收二氧化碳:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| D. | NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
| A. | 表面有黑色氧化铜的热铜丝伸进乙醇中,铜丝会变成紫红色 | |
| B. | C5H12有三种不同的结构,其中一种异构体的名称是2,3-二甲基丙烷 | |
| C. | 有四瓶失去标签的溶液,知道他们是乙醛、乙酸、乙醇和甲酸,用新制的氢氧化铜悬浊液可以将四种溶液一一鉴别 | |
| D. | 切一小块钠投入到盛有约半试管乙醇的试管中,钠在试管的底部会浮起,放出气体后又回到试管底部,再重复前面的现象 |

| A. | N2(g)+O2(g)═2NO(g);△H=+182.6kJ•mol-1 | |
| B. | H2O(g)═H2O(l);△H=-44.0kJ•mol-1 | |
| C. | 形成化学键过程中放出256.6kJ能量的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
 (1)某学生课外活动小组利用图1所示装置分别做如下实验:
(1)某学生课外活动小组利用图1所示装置分别做如下实验: