6.除去下列物质中的杂质选用的试剂和方法最合理的是( )
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 二氧化碳 | 二氧化硫 | NaOH溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 氧化铁 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
5.下列离子方程式书写正确的是( )
| A. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 漂白粉溶液吸收二氧化碳:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| D. | NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
4.下列各组离子中,在给定条件下能够大量共存的是( )
| A. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 无色碱性溶液中:Na+、K+、MnO4-、CO32- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
3.除杂提纯下列各物质,请写出所选化学试剂的化学式及反应的离子方程式.
| 混合物成分 | 化学试剂 | 离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 | ||
| FeCl2中含有少量FeCl3杂质 | ||
| NaNO3中含有少量NaCl杂质 |
2.关于Na2CO3和NaHCO3,下列说法中正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 石灰水能与NaHCO3反应,但不与Na2CO3反应 | |
| D. | 等质量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的质量比为42:53 |
1.能与氯气和盐酸反应且生成不相同氯化物的是( )
| A. | Fe | B. | Al | C. | Mg | D. | Zn |
20.在相同的条件下,下列气体中所含分子数目最多的是( )
| A. | 1mol NH3 | B. | 1g H2 | ||
| C. | 30g O2 | D. | 11.2L标准状况下的Cl2 |
19.为除去实验室制得的CO2气体中的少量HCl气体,最好将混合气体通过( )
| A. | 烧碱溶液 | B. | 饱和碳酸氢钠溶液 | ||
| C. | 饱和碳酸钠溶液 | D. | 饱和氯化钠溶液 |
18.某研究性学习小组设计除去锅炉水垢(CaCO3、Mg(OH)2、CaSO4)的实验,查找各物质的溶解度数据如下.
设计流程如下(所加的试剂均过量):
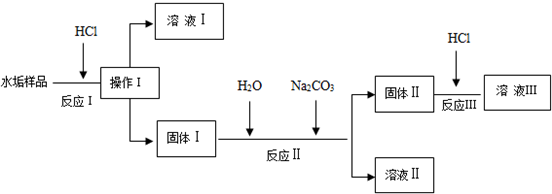
(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.
0 171172 171180 171186 171190 171196 171198 171202 171208 171210 171216 171222 171226 171228 171232 171238 171240 171246 171250 171252 171256 171258 171262 171264 171266 171267 171268 171270 171271 171272 171274 171276 171280 171282 171286 171288 171292 171298 171300 171306 171310 171312 171316 171322 171328 171330 171336 171340 171342 171348 171352 171358 171366 203614
| 化学式 | CaSO4 | CaCO3 | Ca(OH)2 | CaCl2 |
| 溶解度/g | 0.21 微溶 | <0.01 | 0.077 | 74.5 |

(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.