11.下列离子方程式正确的是( )
| A. | 向FeSO4溶液中加入少量Na2O2:4Na2O2+6H2O+4Fe2+═4Fe(OH)3↓+8Na++O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀的质量最大:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 向NaClO溶液中通入少量SO2: 2ClO-+SO2+H2O═2HClO+SO32- | |
| D. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.4 mol/L的Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3•H2O |
10.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如图实验,已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3↑+8AlO2-,根据以上的实验操作与现象,该同学得出的结论正确的是( )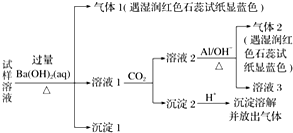

| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 试样与Na2CO3溶液一定不能大量共存 | |
| D. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
5.下列有关物质的分类合理的是( )
| A. | C60、HD均属于单质 | B. | 漂白粉、明矾均属于混合物 | ||
| C. | 氯化铵、硫酸均属于离子化合物 | D. | SO2、NxOy均属于酸性氧化物 |
4.下列化学用语正确的是( )
| A. | 乙烯的结构式:CH2=CH2 | B. | Clˉ的结构示意图: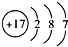 | ||
| C. | I-131:${\;}_{53}^{78}$I | D. | Na2S 的电子式: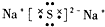 |
3.下列各组离子能在指定溶液中大量共存的是( )
0 171147 171155 171161 171165 171171 171173 171177 171183 171185 171191 171197 171201 171203 171207 171213 171215 171221 171225 171227 171231 171233 171237 171239 171241 171242 171243 171245 171246 171247 171249 171251 171255 171257 171261 171263 171267 171273 171275 171281 171285 171287 171291 171297 171303 171305 171311 171315 171317 171323 171327 171333 171341 203614
| A. | 无色溶液中:K+、Cl-、NH4+、AlO2-、SO42- | |
| B. | 常温下,pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| C. | 室温下,水电离出的c(OH-)=10-13mol•L-1的溶液中:K+、HCO3-、Br-、Ba2+ | |
| D. | 使甲基橙变红的溶液中:Fe2+、Al3+、I-、NO3- |
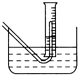 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: