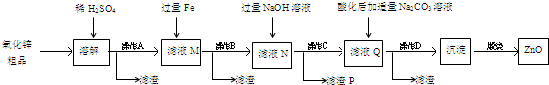
9.已知:
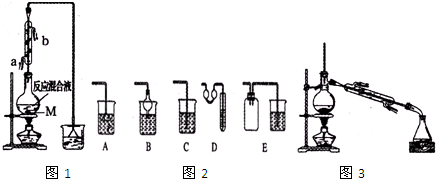
制备1-浪丁烷粗产品在图1装里的圆底烧瓶中依次加人NaBr,lOmL正丁醇.分批加人1,1的硫酸溶液,摇匀,加热30min,发生如下反应:NaBr+H2SO4+CH3CH2CH2OH→CH3CH2CH2Br+NaHSO4+H2O.
(1)反应装置中还需要加人固体M,加人M的目的是防止液体暴沸;.配制体积比为1,1的硫酸所用的玻璃仪器为bcd.a.天平 b.量筒 C.玻璃棒 d.烧杯
(2)冷凝管的进水口是.端,这样选择的原因是能更充分冷凝.
(3)下列图2装置中,能代替图1中最后的收集装里的是B、D、E.
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氛化碳萃取 d.用亚硫酸钠溶液洗涤
(5)制备精品.将得到的粗1一澳丁烷依次用浓硫酸、水、10写碳酸钠、水洗涤后加人无水抓化钙进行干燥,然后再将1-澳丁烷按图3装置燕馏.
①收集产品时,控制的温度应在101.6℃左右,区分1一澳丁烷精品和粗品的一种方法是测熔沸点.
②实验制得的1一澳丁烷的质量为10.895g,则正丁醇的转化率为72.6%.(保留3位小数)
| 药品名称 | 熔点/℃ | 沸点/℃ | 密度g/cm3 | 溶解性 |
| 正丁醇 (CH3CH2CH2OH) | -89.5 | 117.7 | 0.8098 | 微溶于水,溶于浓硫酸 |
| l-溴丁烷 (CH3CH2CH2CH2Br) | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(1)反应装置中还需要加人固体M,加人M的目的是防止液体暴沸;.配制体积比为1,1的硫酸所用的玻璃仪器为bcd.a.天平 b.量筒 C.玻璃棒 d.烧杯
(2)冷凝管的进水口是.端,这样选择的原因是能更充分冷凝.
(3)下列图2装置中,能代替图1中最后的收集装里的是B、D、E.
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氛化碳萃取 d.用亚硫酸钠溶液洗涤
(5)制备精品.将得到的粗1一澳丁烷依次用浓硫酸、水、10写碳酸钠、水洗涤后加人无水抓化钙进行干燥,然后再将1-澳丁烷按图3装置燕馏.
①收集产品时,控制的温度应在101.6℃左右,区分1一澳丁烷精品和粗品的一种方法是测熔沸点.
②实验制得的1一澳丁烷的质量为10.895g,则正丁醇的转化率为72.6%.(保留3位小数)

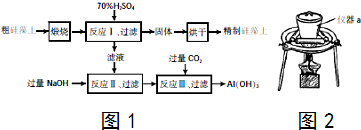
7.硫酸铜是一种应用极其广泛的化工原料,可用不同的方法制得硫酸铜.
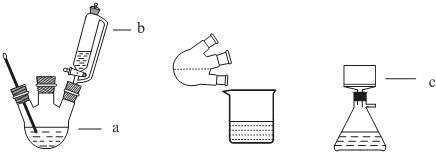
Ⅰ.将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示),把硫酸铜晶体用小火慢慢加热即得无水硫酸铜.
(1)图1分液漏斗内装的液体是浓硝酸.图2是图1的改进装置,与图1相比,图2装置的明显优点是防止倒吸、有害气体能被完全吸收.
(2)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想铜离子对双氧水分解有催化作用..
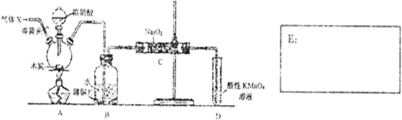
Ⅱ.实验室用浓硫酸与铜反应,以进一步制取少量NaHSO3,实验装置如图3所示:
请回答:
(3)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).某小组同学采用加热法测定该晶体里结晶水x的值.
①请写出装置甲中发生反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②加热法测定该晶体里结晶水x的值,结晶水完全失去的判断方法是两次称量不超过0.1g;
③如表是三次实验数据的平均值
根据表中数据计算出x的实测值为4.
(4)下列说法正确的是bd(填序号).
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3

0 171087 171095 171101 171105 171111 171113 171117 171123 171125 171131 171137 171141 171143 171147 171153 171155 171161 171165 171167 171171 171173 171177 171179 171181 171182 171183 171185 171186 171187 171189 171191 171195 171197 171201 171203 171207 171213 171215 171221 171225 171227 171231 171237 171243 171245 171251 171255 171257 171263 171267 171273 171281 203614
Ⅰ.将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示),把硫酸铜晶体用小火慢慢加热即得无水硫酸铜.
(1)图1分液漏斗内装的液体是浓硝酸.图2是图1的改进装置,与图1相比,图2装置的明显优点是防止倒吸、有害气体能被完全吸收.
(2)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想铜离子对双氧水分解有催化作用..
Ⅱ.实验室用浓硫酸与铜反应,以进一步制取少量NaHSO3,实验装置如图3所示:
请回答:
(3)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).某小组同学采用加热法测定该晶体里结晶水x的值.
①请写出装置甲中发生反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②加热法测定该晶体里结晶水x的值,结晶水完全失去的判断方法是两次称量不超过0.1g;
③如表是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 23.3g | 19.7g |
(4)下列说法正确的是bd(填序号).
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3

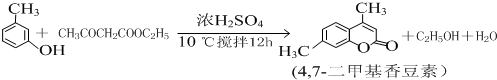
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+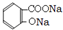 .
.
 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是: