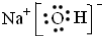题目内容
12.4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下: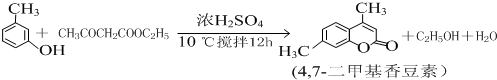
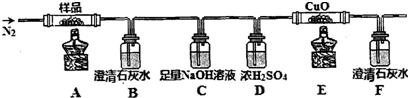
实验装置图如下:
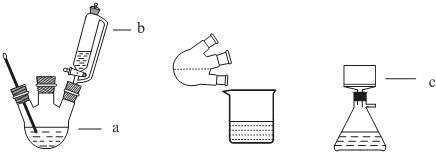
主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物.
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g.
(1)图中仪品名称:a三颈烧瓶,c布氏漏斗.
(2)简述装置b中将活塞上下部分连通的目的平衡上下气压,使漏斗中液体顺利流下.
(3)浓H2SO4需要冷却至0℃以下的原因是防止浓硫酸将有机物氧化和炭化.
(4)反应需要搅拌12h,其原因是使反应物充分接触反应,提高反应产率.
(5)确定最终产品是4,7-二甲基香豆素的实验或方法是测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等.
(6)本次实验产率为89.3%.
分析 (1)根据装置图分析:a为三个颈的烧瓶,为三颈烧瓶,C为布氏漏斗;
(2)根据实验的需要结合大气压强原理来回答,装置b中将活塞上下部分连通,能平衡上下气压,使漏斗中液体顺利流下;
(3)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(4)反应需要搅拌12h,使反应物充分接触反应,提高反应产率;
(5)4,7-二甲基香豆素熔点较低,可以测量熔点,也可以通过实验仪器,红外光谱仪用于测定有机物的官能团;核磁共振仪用于测定有机物分子中氢原子的种类和数目;
(6)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率.
解答 解:(1)由装置图分析可知a为三颈烧瓶,b为恒压滴液漏斗,吸滤瓶上的C为布氏漏斗,故答案为:三颈烧瓶;布氏漏斗;
(2)装置中装置b中将活塞上下部分连通具有平衡气压的作用,使漏斗中间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物顺利流下,
故答案为:平衡上下气压,使漏斗中液体顺利流下;
(3)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,
故答案为:防止浓硫酸将有机物氧化和炭化;
(4)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,故答案为:使反应物充分接触反应,提高反应产率;
(5)4,7-二甲基香豆素(熔点:132.6℃)熔点较低,可以测量熔点,红外光谱仪用于测定有机物的官能团;核磁共振仪用于测定有机物分子中氢原子的种类和数目,也可以通过实验仪器测定其红外(紫外)光谱(及核磁共振氢谱)等方法来检验最终产品是4,7-二甲基香豆素;
故答案为:测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等;
(6)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL(0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算理论产量为0.21mol×176g/mol=36.96g,则产率为$\frac{33.0g}{36.96g}$×100%≈89.3%,
故答案为:89.3%.
点评 本题考查了有机物的制备实验,侧重于实验仪器、实验操作、产率的计算的考查,题目难度中等,考查了学生的实验探究能力.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 0.68g | B. | 0.81g | C. | 0.91g | D. | 1.21g |
Ⅰ.将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示),把硫酸铜晶体用小火慢慢加热即得无水硫酸铜.
(1)图1分液漏斗内装的液体是浓硝酸.图2是图1的改进装置,与图1相比,图2装置的明显优点是防止倒吸、有害气体能被完全吸收.
(2)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想铜离子对双氧水分解有催化作用..
Ⅱ.实验室用浓硫酸与铜反应,以进一步制取少量NaHSO3,实验装置如图3所示:
请回答:
(3)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).某小组同学采用加热法测定该晶体里结晶水x的值.
①请写出装置甲中发生反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②加热法测定该晶体里结晶水x的值,结晶水完全失去的判断方法是两次称量不超过0.1g;
③如表是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 23.3g | 19.7g |
(4)下列说法正确的是bd(填序号).
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3

①水泥路桥 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.
所用材料为SiO2或要用到SiO2的是( )
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
| A. | 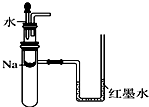 验证Na和水反应是否为放热反应 | B. | 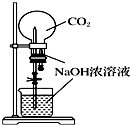 用CO2做喷泉实验 | ||
| C. |  观察纯碱的焰色反应 | D. | 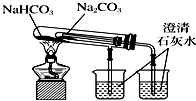 比较NaCO3、NaHCO3的稳定性 |
| A. | Na2SO3溶液加水稀释后,pH和KW均减小 | |
| B. | 0.1mol•L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 浓度分别为0.2mol•L-1和0.1mol•L-1的CH3COOH溶液中,c(H+)之比等于2:1 | |
| D. | 室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性 |