题目内容
3.铁及其化合物在日常生活中应用广泛,请回答下列问题:(1)Fe(NO3)3•9H2O在工业上用细铁屑与稀硝酸反应制备,主要流程如下:
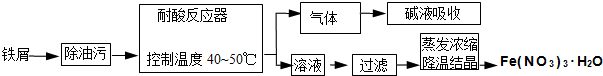
①耐酸反应器中可以观察到的现象是铁屑溶解,溶液变为黄色,有无色气体产生,在液面上气体变为红棕色(后又变为无色).制备过程中需对溶液进行蒸发浓缩,注意事项为边加热边不断搅拌,防止局部过热,液体发生飞溅.
②从反应器中出来的气体的主要成分是氮氧化物;直接排放到大气中造成环境污染的后果是形成酸雨和光化学烟雾;
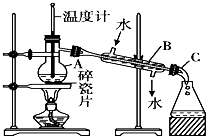
(2)某兴趣小组在实验室用如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).

①该实验中对圆底烧瓶加热的最佳方式用水浴加热;
②请在图中虚线框内画出防止倒吸的尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
分析 (1)铁和过量稀硝酸反应,产物为Fe3+和NO,现象是溶液变黄色,产生无色气体,NO又能被空气中氧气氧化,生成二氧化氮,二氧化氮又与水反生成无色的NO,加热蒸发时应注意搅拌散热,氮氧化物造成的污染主要为酸雨和光化学污染,据此答题;
(2)制取Fe(NO3)3•9H2O需要控制的温度为40-50℃,水浴加热更容易控制,铁与硝酸反应后有氮的氧化物产生,氮的氧化物有毒,不放到空气中,所以要用防倒吸的尾气吸收装置,用NaOH溶液吸收,据此画装置图.
解答 解:(1)①铁和过量稀硝酸反应,产物为Fe3+和NO,NO又能被空气中氧气氧化,生成二氧化氮,二氧化氮又与水反生成无色的NO,所以现象是铁屑溶解,溶液变为黄色,有无色气体产生,在液面上气体变为红棕色(后又变为无色),对溶液进行蒸发浓缩,注意事项为加热蒸发时应注意边加热边不断搅拌,防止局部过热,液体发生飞溅,
故答案为:铁屑溶解,溶液变为黄色,有无色气体产生,在液面上气体变为红棕色(后又变为无色);边加热边不断搅拌,防止局部过热,液体发生飞溅;
②铁和过量稀硝酸反应,产物为Fe3+和NO,NO又能被空气中氧气氧化,所以从反应器中出来的气体的主要成分是氮氧化物,氮氧化物直接排放到大气中会造成的污染主要为酸雨和光化学污染,
故答案为:氮氧化物;形成酸雨和光化学烟雾;
(2)①制取Fe(NO3)3•9H2O需要控制的温度为40-50℃,水浴加热更容易控制,所以该实验中对圆底烧瓶加热的最佳方式用 水浴加热,
故答案为:水浴;
②铁与硝酸反应后有氮的氧化物产生,氮的氧化物有毒,不放到空气中,所以要用防倒吸的尾气吸收装置,用NaOH溶液吸收,所以装置图为 ,
,
故答案为: .
.
点评 考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、作图能力等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| 物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
| SO2 | 2mol | |||
| SO42- | 6.02×1022 | |||
| NH4+ | 18g | . |
| A. | NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H20反应中,储氢、释氢过程均无能量变化 | |
| B. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| C. | 化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律 | |
| D. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的△H相等 |
1,2-二溴乙烷主要的物理性质如下:
| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g•cm-3 | 难溶于水,易溶于醇,醚生等有机溶剂 |
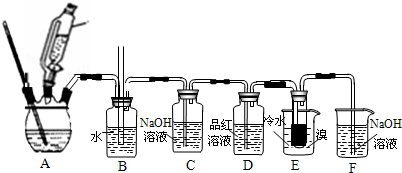
(1)装置A是由乙醇制备乙烯的反应装置图,其中使用连通滴液漏斗的原因是使连通滴液漏斗里的溶液容易流下.
(2)装置B是安全瓶,用于监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升
装置E中盛放泠水的主要目的是避免溴大量挥发(乙烯与溴反应时放热),但又不能过冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管.
(3)装置C的作用是吸收乙烯中混有的SO2、CO2,装置F中发生反应的离子方程式为Br2+20H+=Br-+BrO-+H2O
(4)将1,2-二溴乙烷粗产品置于分钟液漏斗中加水,振荡后静置,产物在下层(填“上”或“下”)
(5)有学生提出,装置D中可改用酸性高锰酸钾溶液来验证气体,请判断这种做法是否可行否(填“是”或“否”),其原因是乙烯和SO2均能与酸高锰酸钾溶液反应.

 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
 请回答实验室分馏石油的有关问题:
请回答实验室分馏石油的有关问题: