14.有①直馏汽油、②裂化汽油、③苯、④聚乙烯、⑤裂解气、⑥环己烷、⑦邻二甲苯、⑧环己烯(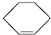 )其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
)其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
 )其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )
)其中既能使KMnO4酸性溶液褪色又能与溴水反应使溴水褪色的是( )| A. | ②④⑤⑧ | B. | ②⑤⑧ | C. | ②④⑤⑦ | D. | ②④⑤⑦⑧ |
13.下列事实能用化学平衡移动原理解释的是( )
| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
10.将1L 1.00mol•L-1的纯碱溶液逐滴加入到1L 1.25mol•L-1的盐酸中;再做相反操作,将1L 1.25mol•L-1的盐酸逐滴加入到1L 1.00mol•L-1的纯碱溶液中.两次操作在同温同压下,前者所产生气体的体积与后者产生的气体体积比是( )
| A. | 2:5 | B. | 1:1 | C. | 2:1 | D. | 5:2 |
8.Ⅰ维生素C(C6H8O6)主要存在于蔬菜、水果中,它能增强人体对疾病的抵抗能力.
(1)取三片维生素C,压碎后溶于100mL水中过滤.取少量滤液向其中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈酸性.
(2)维生素C在酸性环境中比较稳定,在高温时易被破坏.请你想一想,如何食用黄瓜,才能充分利用黄瓜中丰富的维生素C?食用黄瓜时最好加点醋凉拌.
Ⅱ某保健食品的外包装标签上的部分内容如下:
(1)该保健食品的主要功能是补钙.
(2)服用后,该保健食品中的碳酸钙与胃液中的盐酸发生反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)食用方法中嚼食的作用是增大反应物的接触面积,促进钙的吸收.
(1)取三片维生素C,压碎后溶于100mL水中过滤.取少量滤液向其中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈酸性.
(2)维生素C在酸性环境中比较稳定,在高温时易被破坏.请你想一想,如何食用黄瓜,才能充分利用黄瓜中丰富的维生素C?食用黄瓜时最好加点醋凉拌.
Ⅱ某保健食品的外包装标签上的部分内容如下:
| 主要原料:碳酸钙 食用方法:每日一次,每次一片,嚼食. |
(2)服用后,该保健食品中的碳酸钙与胃液中的盐酸发生反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)食用方法中嚼食的作用是增大反应物的接触面积,促进钙的吸收.
6.按要求回答以下问题:
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为 .
.
②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为 (用相关的化学用语作答).
(用相关的化学用语作答).
③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

0 170986 170994 171000 171004 171010 171012 171016 171022 171024 171030 171036 171040 171042 171046 171052 171054 171060 171064 171066 171070 171072 171076 171078 171080 171081 171082 171084 171085 171086 171088 171090 171094 171096 171100 171102 171106 171112 171114 171120 171124 171126 171130 171136 171142 171144 171150 171154 171156 171162 171166 171172 171180 203614
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为
 .
.②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为
 (用相关的化学用语作答).
(用相关的化学用语作答).③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
| 元素 | Mn | Fe |
| 电离能 | ||
| (kJ•mol-1) | ||
| I1 | 717 | 759 |
| I2 | 1 509 | 1561 |
| I3 | 3 248 | 2 957 |
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

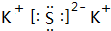 .
. 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行了有关实验:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行了有关实验:
 .
.