题目内容
11. 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行了有关实验:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行了有关实验:(1)B是用来收集实验中产生气体的装置,但未将导管画全,请你补充完整(用文字表达)B装置中导气管长进短出.
(2)实验中他们取6.4g铜片和12mL18mol•L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识,认为还有一定量的硫酸剩余.
①请写出铜跟浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:随着反应进行,硫酸被消耗,浓硫酸变成稀硫酸,稀硫酸和铜不反应.
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是AD(填字母编号)
A.铁粉B.BaCl2溶液C.银粉D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某学生进行了如下设计:
该学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是B(填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过盛有足量碱石灰的干燥管,结束反应后再次称量
B.用排饱和NaHSO3的方法测定产生气体的体积
C.用排水法测定装置A产生气体的体积(已换算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥,称量沉淀
(4)请你另设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气量计算剩余硫酸的物质的量浓度.
分析 (1)依据实验产生的气体是二氧化硫,二氧化硫密度比与空气大,确定收集实验中产生的气体的装置中导气管的位置;
(2)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水;
②随着反应的进行,浓硫酸逐渐成为稀硫酸,而铜与稀硫酸不反应;
③根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子即可;
(3)①A、碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大;
B、高锰酸钾溶液中含有硫酸,与氯化钡反应生成沉淀增大;
C、二氧化硫在水中以1:40溶解,收集二氧化硫体积减少;
D、亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,产生固体质量增大;
(4)可利用剩余的稀硫酸与锌反应放出氢气,通过氢气的量计算剩余硫酸的物质的量浓度;
解答 解:(1)铜跟浓硫酸反应生成了二氧化硫气体,二氧化硫密度比与空气大,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为: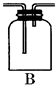
故答案为:B装置中导气管长进短出;
(2)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;
②铜与浓硫酸在加热条件下可以发生反应,而铜与稀硫酸不反应,随着反应的进行,硫酸浓度浓度降低,当浓硫酸逐渐成为稀硫酸时反应停止;
故答案为:随着反应进行,硫酸被消耗,浓硫酸变成稀硫酸,稀硫酸和铜不反应;
③根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子,
A、铁粉与氢离子反应产生气泡,故A正确;
B、BaCl2溶液只能与硫酸根产生沉淀,故B错误;
C、银粉不反应,无现象,故C错误;
D、Na2CO3溶液与氢离子反应产生气泡,故D正确;
故选:AD;
(3)A、碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大,导致余酸的物质的量浓度偏低,故A错误;
B、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故B正确;
C、二氧化硫在水中以1:40溶解,收集二氧化硫体积减少,导致余酸的物质的量浓度偏高,故C错误;
D、亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,产生固体质量增大,导致余酸的物质的量浓度偏低;
故选:B;
(4)Zn和稀硫酸反应生成氢气,因此可向反应后溶液中加入足量的锌粒,收集并测定氢气的体积,通过氢气量计算剩余硫酸的物质的量浓度;
故答案为:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气量计算剩余硫酸的物质的量浓度.
点评 本题考查了铜跟浓硫酸的反应情况,涉及反应产物的验证、测定方法的设定和判断,关键是产物中的二氧化硫的性质应用和含量测定是解题的难点,难度较大.

| A. | 该溶液的pH=4 | |
| B. | 适当升高温度,溶液的pH不变 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 由HX电离出的c(H+)约为水电离出的c(OH-)的106倍 |
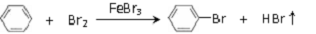
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按
如图2流程分离产品:
已知:溴苯难溶于水,与有机溶剂互溶;溴、苯、溴苯的沸点依次为59℃、80℃、156℃.
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)向“水洗”后所得水相中滴加KSCN溶液,溶液变红色.推测水洗的主要目的是除去FeBr3.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子,并设计实验方案验证你的推测.
(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量Br- | ||
| 3 | 锥形瓶中液体含大量H+ |

(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为
 .
.②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为
 (用相关的化学用语作答).
(用相关的化学用语作答).③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
| 元素 | Mn | Fe |
| 电离能 | ||
| (kJ•mol-1) | ||
| I1 | 717 | 759 |
| I2 | 1 509 | 1561 |
| I3 | 3 248 | 2 957 |
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 鸡蛋白溶液中分别滴入饱和硫酸铵和醋酸铅溶液 | 均有固体析出 | 均发生变性 |
| B | 溴水中分别加入苯酚和环己烯 | 溴水均褪色 | 均发生加成反应 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 适量水玻璃加入稀盐酸中, 振荡得透明溶液,用激光笔照射 | 有丁达尔效应 | 有硅酸胶体生成 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. | 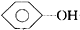 +NaHCO3→ +NaHCO3→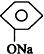 +H2CO3 +H2CO3 | |
| C. | 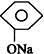 +CO2+H2O→ +CO2+H2O→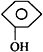 +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→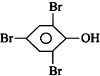 ↓+3HBr ↓+3HBr |
| A. | 冰水混合物 | B. | 水泥 | C. | 纯净的盐酸 | D. | 普通玻璃 |
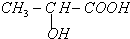 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.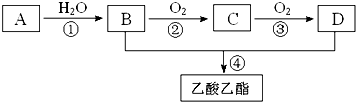
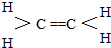 .
.